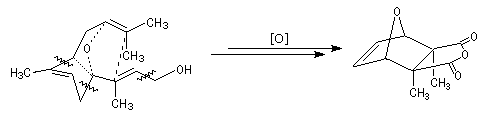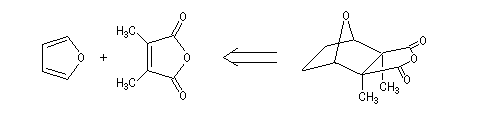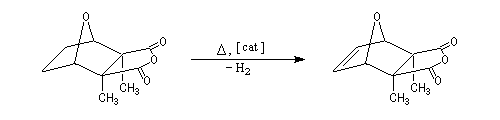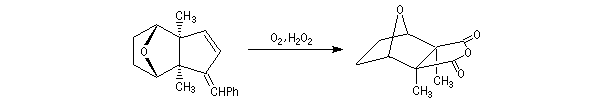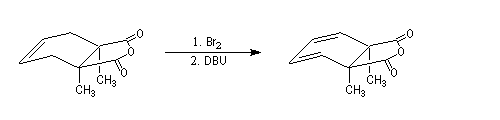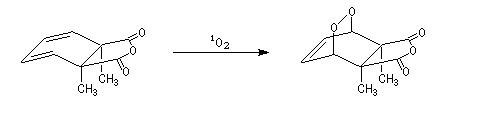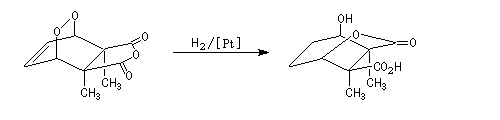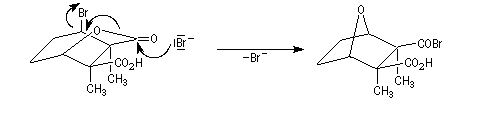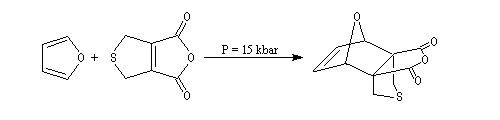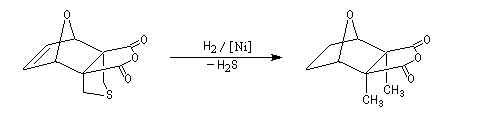La cantharidine : origine et synthèses
Gérard Dupuis & Nicole Berland
Lycée Faidherbe - LILLE
Autre version : Version HTML
Qu'est ce que la cantharidine ?
La cantharidine, isolée pour la première fois par le pharmacien français Robiquet en 1810, joue un rôle important dans l'écologie de
plusieurs types d'insectes qui l'utilisent comme moyen de défense afin de préserver leurs oeufs des prédateurs [1]. Dès l'antiquité, donc bien avant qu'on connaisse la structure du principe actif, les mouches espagnoles séchées avaient la réputation d'avoir des vertus aphrodisiaques [27]. En réalité,
les propriétés supposées de la cantharidine ne sont attestées ni par la théorie ni par l'expérience. En revanche, il s'agit d'une substance dangereuse dont la toxicité est comparable à celle des poisons les plus violents comme la strychnine.
|

|
Deux familles d'insectes appartenant à l'ordre des coléoptères produisent cette substance :
les Meloidae et les Oedemeridae [20]. La première famille regroupe plusieurs milliers d'espèces parmi lesquelles celles qui appartiennent au genre Epicauta sont les plus répandues. Leur représentant le plus connu
est appelé Lytta Vesicatoria ou Mouche Espagnole (Spanish fly) dont un exemple est représenté sur la photographie de gauche.
|
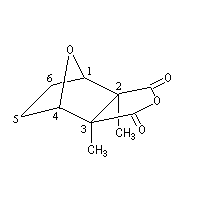
Molécule de cantharidine
A la température ordinaire, la cantharidine se présente comme un composé incolore, inodore, de formule brute C10H12O4, fondant à 218 °C.
|
|
La cantharidine ou anhydride 2, 3-diméthyl-7-oxabicyclo[2, 2, 1]heptane-2, 3-dicarboxylique, dont la molécule est représentée à gauche, est un composé achiral du fait de l'existence d'un plan de symétrie passant par le milieu des
liaisons C2C3 et C5C6. C'est un composé méso (2S, 3R).
|
Une molécule dont la structure est très proche de la cantharidine est la palasonine. Cette molécule est produite par un arbre (butea frondosa) originaire de l'Himalaya. Contrairement à la cantharidine, la palasonine est chirale et il existe deux énantiomères. Le composé naturel est la (-)-palasonine. Le modèle correspondant est représenté ci-dessous.
|
|
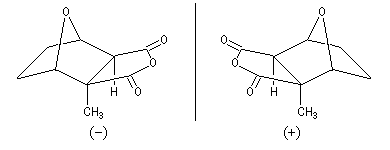
Les deux énantiomères de la palasonine, seul le composé de gauche existe à l'état naturel
|
Biosynthèse
Chez les insectes, la cantharidine est produite par l'adulte mâle et transférée aux femelles durant la copulation. Le mécanisme complet de sa biosynthèse n'est pas complètement élucidé à l'heure actuelle. Cependant, il n'est pas douteux que celui-ci fait intervenir une série de réactions impliquant comme substrat de départ un alcool terpénique : le farnésol. Une preuve en a été apportée par une technique de spectrométrie de masse utilisant les isotopes 14C, 3H, 18O [9].
|
|
Le farnésol ou (E, E)-3, 7, 11-triméthyldodéca-2, 6, 10-triène-1-ol est un alcool sesquiterpénique. C'est un intermédiaire dans la biosynthèse des polyisoprénoïdes.
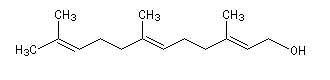
Le farnésol est assez abondant à l'état naturel. On le trouve dans de nombreuses essences comme celle d'Ylang-ylang.
|
Le schéma ci-dessous montre le schéma des réactions de coupure, et d'insertion d'oxygène sur une conformation repliée de la
molécule de farnésol [20].
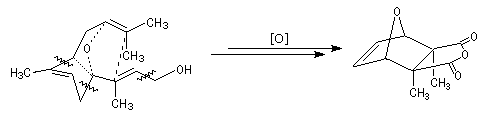
Mode d'action
Le mode d'action de la cantharidine fait intervenir l'inhibition de la protéinephosphatase 2A (PP2A), une enzyme intervenant dans le métabolisme du glycogène [23].
Tentatives initiales de synthèses de la cantharidine
La première tentative de synthèse de la cantharidine est à mettre à l'actif du chimiste allemand von Bruchhausen [2]. Elle se fondait sur l'analyse rétrosynthétique suivante.
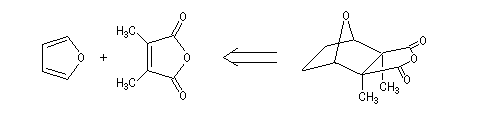
Malheureusement la réaction de Diels-Alder entre le dérivé diméthylé de l'anhydride phtalique et le furane conduit à un équilibre très
défavorable au produit. Cette interprétation est validée par l'expérience suivante. Lorsque la cantharidine naturelle est déshydrogénée, le produit de cette déshydrogénation subit spontanément une réaction de rétro-Diels-Alder.
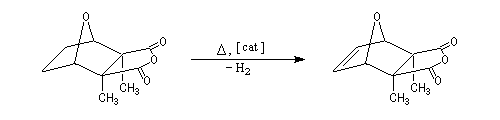
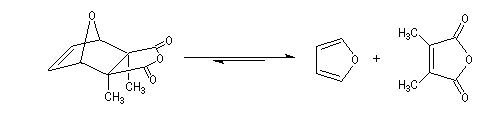
Une étude plus approfondie montre que l'instabilité du produit trouve son origine dans la répulsion entre les groupes méthyle portés par C2 et C3 et les atomes d'hydrogène portés par C5 et C6 (le recouvrement des sphères de Van der Waals est visible sur le modèle
moléculaire de la molécule dans la représentation "spacefill").
Synthèses de la cantharidine
Synthèse de Stork
La première synthèse effective de la cantharidine a été effectuée en 1951 par le chimiste américain d'origine belge G. Stork [4] et [5]. La synthèse de Stork est complètement linéaire et ne fait intervenir que des réactions classiques. Elle est emblématique des synthèses
totales de produits naturels datant de cette époque.
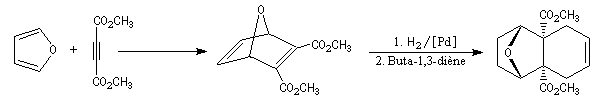
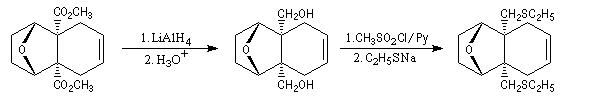
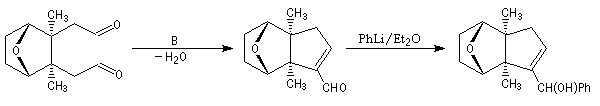
LiAlH4 permet la réduction des fonctions esters. La sulfonylation des fonctions alcools obtenues par le chlorure de méthanesulfonyle, permet d'améliorer le caractère nucléofuge du groupe hydroxy. De ce fait, la substitution
nucléophile par un thiolate est rendue possible.
La dihydroxylation de la double liaison éthylénique est réalisée par le tétroxyde d'osmium. La réduction des fonctions thioéthers permet l'introduction des groupes méthyles. L'action de l'acide périodique sur l'a-glycol permet la coupure du cycle et la formation de deux fonctions aldéhydes.
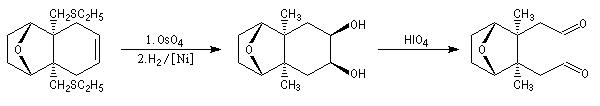
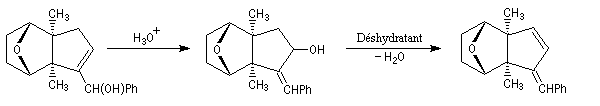
La formation d'un cycle à cinq chaînons est réalisée par une condensation aldol suivie d'une déshydratation de l'aldol formé. L'addition nucléophile de phényllithium permet de passer à l'alcool secondaire.
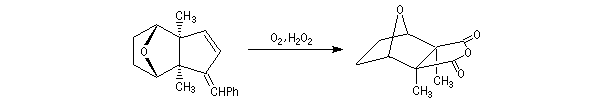
Synthèse de Schenk
La synthèse de Schenk utilise aussi une réaction de Diels-Alder comme point de départ. Mais le système ponté qui introduisait des interactions sévères avec les groupes méthyles dans la synthèse de Von Bruchausen, n'existe pas ici ce qui permet à l'équilibre
d'être favorable à l'adduit [6].
Un système diénique est préparé grâce à une addition de Br2 sur la double liaison éthylénique suivie d'une double élimination sous l'action du DBU.
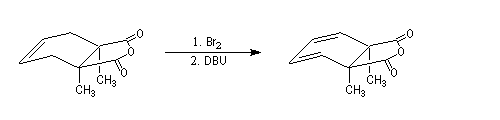
Le sigle DBU désigne le 1,8-diazabicyclo[5.4.0]undéc-7-ène. Il s'agit d'une base encombrée permettant de promouvoir des
éliminations.
La première étape clé de la synthèse est la cycloaddition [4+2] de l'oxygène singulet synthétisé photochimiquement.
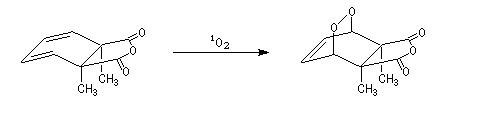
La réduction catalytique par H2 de la liaison peroxo peu stable conduit à une a-hydroxy-lactone.
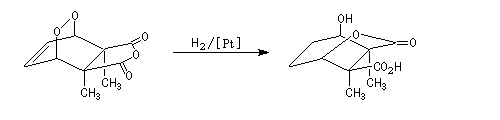
Le traitement par HBr permet la substitution du groupe hydroxy par un atome de brome.
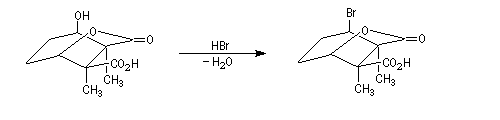
La deuxième étape clé est l'ouverture de la lactone suivie de la formation du pont oxo par une réaction de transposition et départ d'un ion bormure.
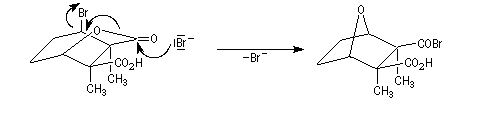
L'halogénure d'acyle formé dans la réaction précédente réagit avec la fonction acide carboxylique pour former l'anhydride cyclique.
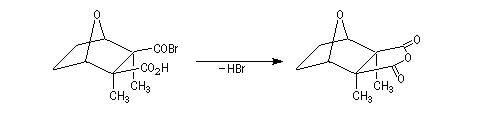
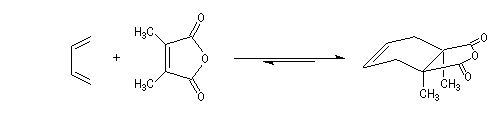
Synthèse de Dauben
Dauben est un chimiste américain de l'Université de Berkeley qui a réalisé de nombreuses synthèses en utilisant des pressions élevées. La réaction de Diels-Alder est ici rendue possible par l'utilisation
d'une pression de 15 kbar. Cela permet d'effectuer la synthèse de la cantharidine en seulement deux étapes [7], [8].
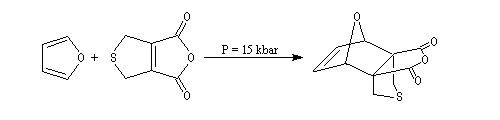
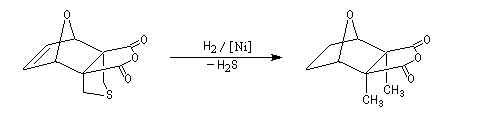
Références bibliographiques
[1] Robiquet. M. Ann. Chim. 1810, 76, 302-307.
[2] von Bruchhausen, F.; Bersch, II. W. Arch. Pharm. Ber. Disch. Phurm. Ges. 1928, 266, 697-702.
[3] Diels. O.; Alder, K. Ber. 1929, 62, 554-562.
[4] Stork, G.; and al.J. Am. Chem. Soc. 1951, 73, 4501.
[5] Stork, G.; van Tamelen, E. E.; Friedman, L. I.; Burgstahler, A. W. J. Am. Chem. Soc. 1953, 75, 384.
[6] Schenck, G.; Wirtz, R. Naturwissenshaften 1953, 40, 531.
[7] Dauben, W. G.; Kessel, C. R.; Takemura, K. H. J. Am. Chem. Soc. 1980, 102, 6893-6894.
[8] Dauben, W. G.; Krabbenhoft, II. O. J. Am. Chem. Soc. 1976, 98, 1992-1993.
[9] McCormick, J. P.; Carrel, J. E.; Doom, J. P. J. Am. Chem. Soc. 1986, 108, 8071-8074.
[10] Sierra, J. R.; Woggon, W. D.; Schmid, H. Experientia 1976, 32, 142-144.
Liens
[20] Ecology and Biosynthesis of Cantharidin and Palasonin
[21] O. Diels and K. Alder the Nobel Prize in Chemistry 1950
[22] Oxygen inorganic photochemistry
[23] Design and synthesis of selective phosphatase inhibitors
[24] Cantharidin : A Historical Overview and Synthetic Approach
[25] How does cantharidine work and what is it used for
[26] The British Pharmaceutical Codex, Cantharis B. P.
[27] Aphrodisiacs their biological basis
[28] Blister beetle intoxication
[PAGE D'ACCUEIL] [MOTM HOME PAGE]
Vous pouvez, si vous le souhaitez, utiliser le contenu de cette page dans un but pédagogique et non commercial
Gérard Dupuis Lycée Faidherbe LILLE
décembre 2003