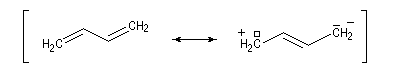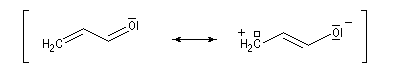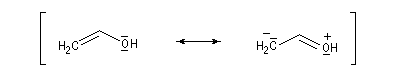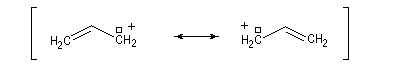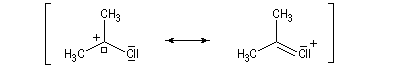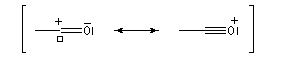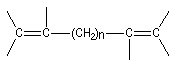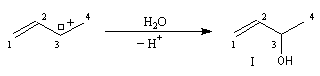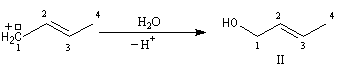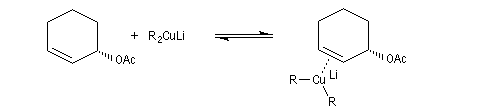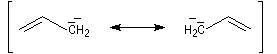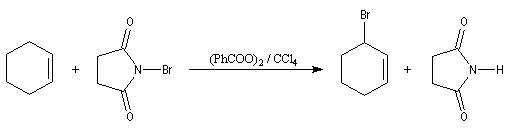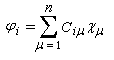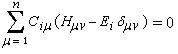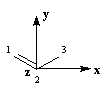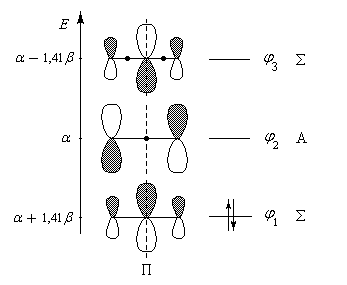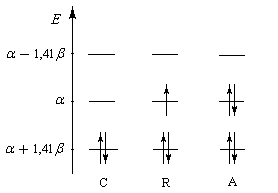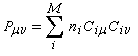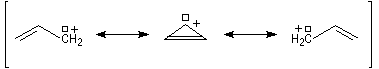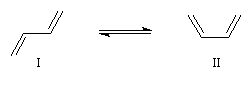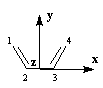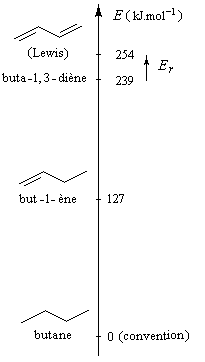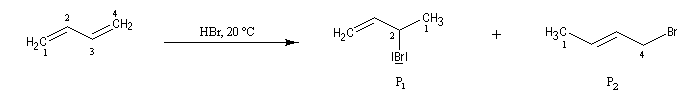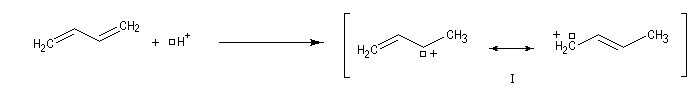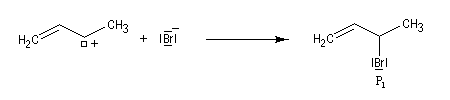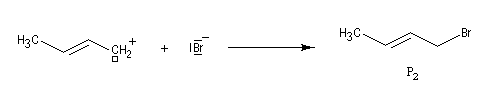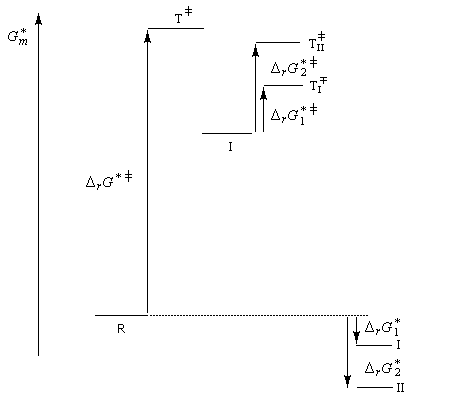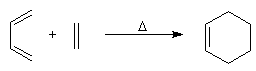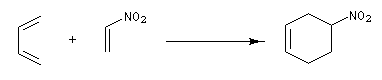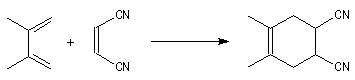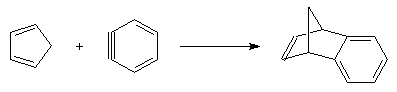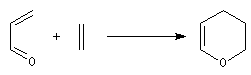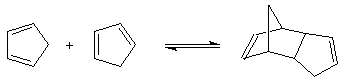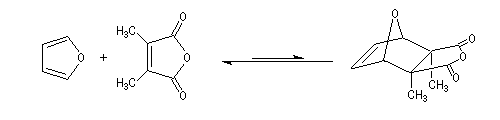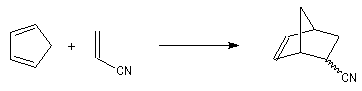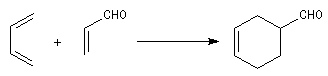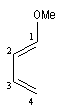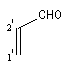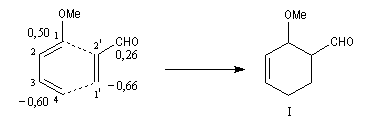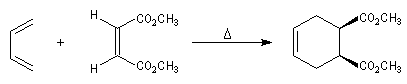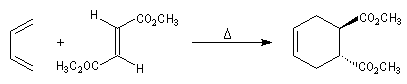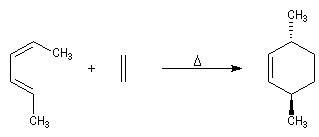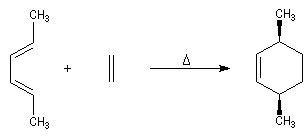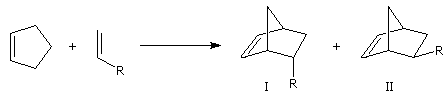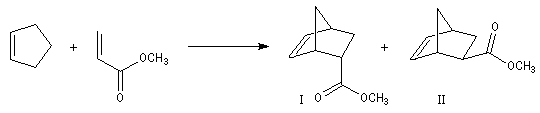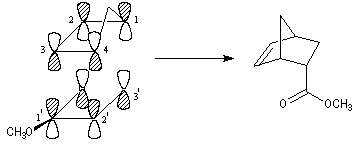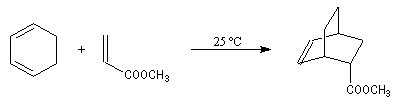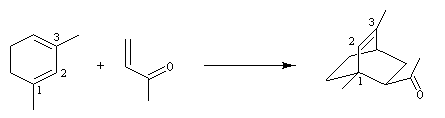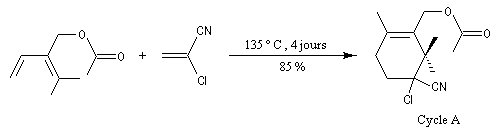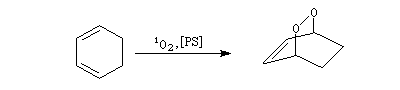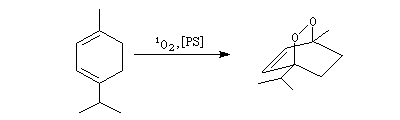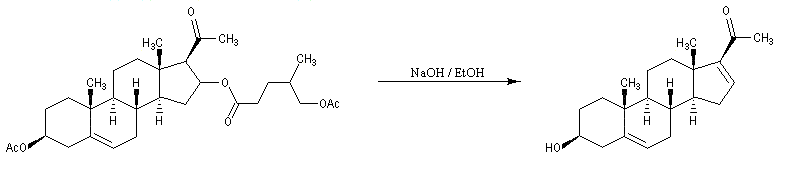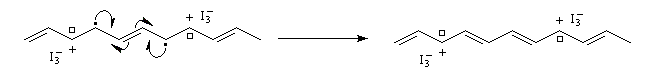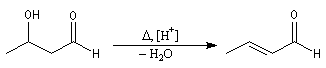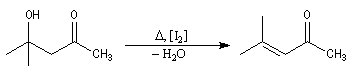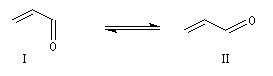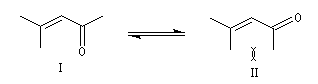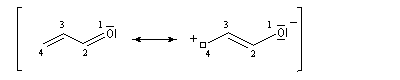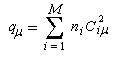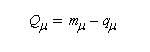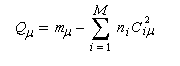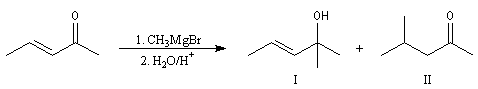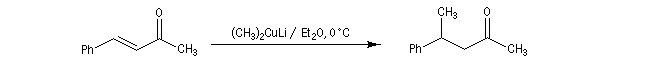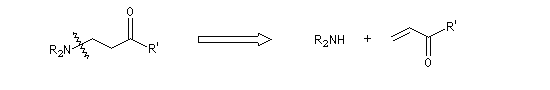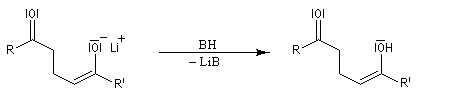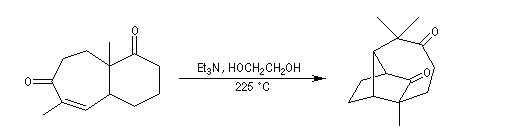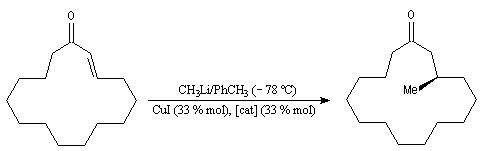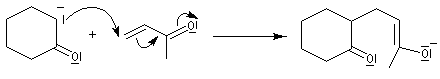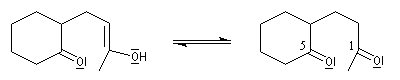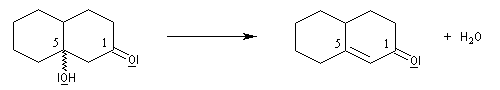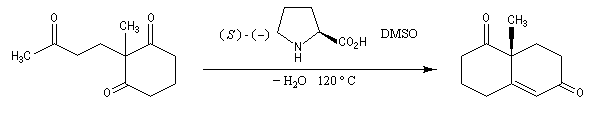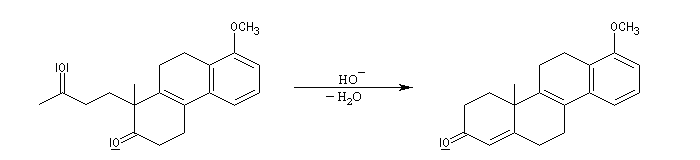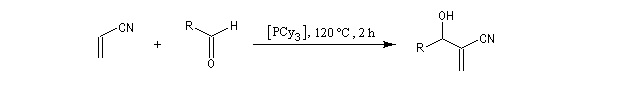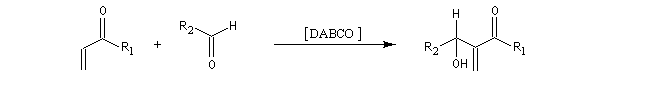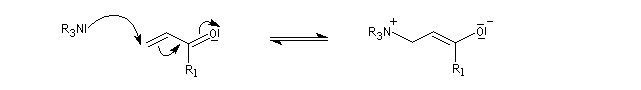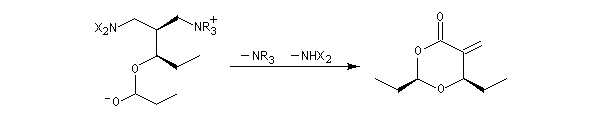Cours de chimie Organique - G. Dupuis - Lycée Faidherbe de Lille
Systèmes conjugués
Introduction
Définitions
Il y a plusieurs définitions possibles d'un système conjugué. Nous utiliserons la suivante : on appelle système conjugué, un ensemble d'atomes ayant des orbitales atomiques pouvant se recouvrir
latéralement et permettant de fortes interactions électroniques entre au moins trois atomes contigus [15], [17]. Les systèmes conjugués ont une réactivité originale car la délocalisation entraîne une certaine ambiguïté dans la répartition électronique. Dans les exemples suivants, le système est représenté par
des formes mésomères limites :
- systèmes p s p : à cette catégorie appartiennent les diènes conjugués dont le représentant le plus simple est le buta-1, 3-diène ;
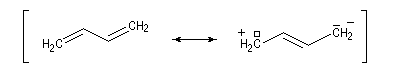
les a-énones sont aussi des systèmes de ce type.
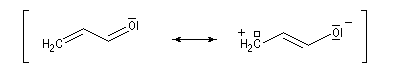
- systèmes n s p : dans cette catégorie, on trouve par exemple les énols et les énolates de composés carbonylés.
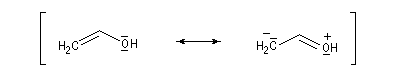
- systèmes p s v : comme exemple de tels systèmes nous prendrons celui du cation prop-2-ényle appelé de façon courante cation allyle.
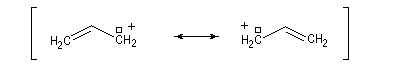
- systèmes n s v : le recouvrement des orbitales ne concerne que deux atomes, on ne peut plus vraiment parler de systèmes conjugués.
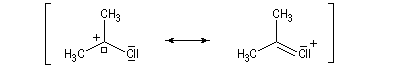
La délocalisation électronique explique la plus grande stabilité des carbocations possédant un hétéroatome en a par rapport aux carbocations ordinaires. Tout hétéroatome possédant un doublet non liant
décrit par une orbitale de géométrie adéquate peut convenir. Les ions acylium en constituent un exemple :
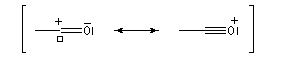
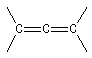
En revanche deux des composés ci-dessous, comportent deux liaisons doubles mais ne sont pas des systèmes conjugués.
|
|
|
|
|
non conjugué |
conjugué |
non conjugué |
Lorsque deux liaisons doubles partent du même atome de carbone il s'agit d'un diène cummulé ou allène. Les recouvrements des orbitales p s'effectuent dans des plans perpendiculaires. En conséquence, les allènes dissymétriques présentent le phénomène de chiralité axiale et peuvent être dédoublés en énantiomères.
Les hydrocarbures aromatiques sont des polyènes conjugués cycliques ou [p]-annulènes répondant à des critères particuliers. Ils font l'objet d'un chapitre spécifique.
Quelques diènes conjugués importants
Spectroscopie
Domaine ultraviolet-visible
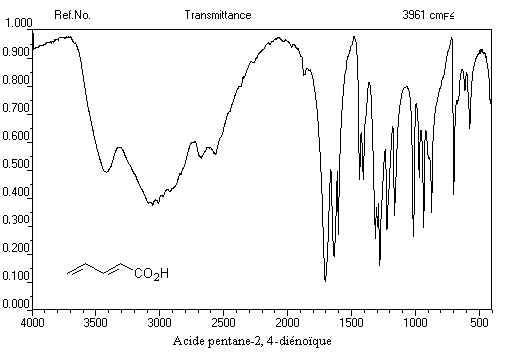
Le spectre ci-dessous est celui du penta-1, 3-diène. Il est typique d'un spectre de diène. On observe une bande large dont le maximum d'absorption est voisin de 225 nm.
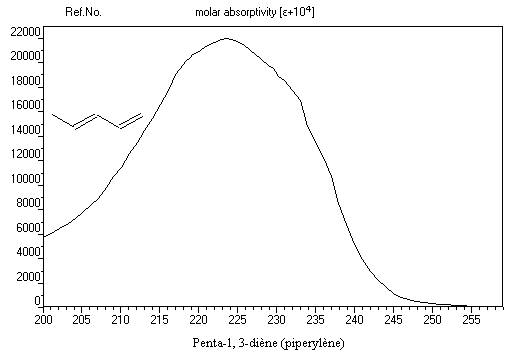
Quand la taille du système conjugué croit, on assiste à une augmentation de la longueur d'onde du maximum d'absorption. Cet effet porte le nom d'effet bathochrome. Lorsque le nombre
de double liaisons conjuguées est assez élevé, la molécule absorbe la lumière dans la partie visible du spectre. Le composé présente alors la couleur complémentaire
de celle qui est absorbée. C'est ainsi que le b-carotène dont la molécule possède 11 doubles liaisons conjuguées, absorbe la lumière bleue. Il a une couleur orange.
|
Composés |
lM (nm) |
log e |
|
éthène |
162,5 |
3,94 |
|
buta-1, 3-diène |
217 |
4,32 |
|
hexa-1, 3, 5-triène |
247 |
4,53 |
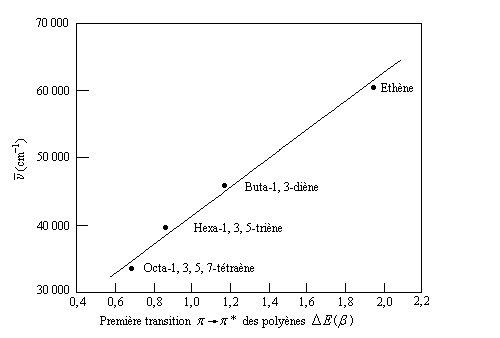
La première transition p ® p* s'effectue entre la plus haute orbitale moléculaire occupée (HO) et la plus basse orbitale moléculaire vacante (BV). En vertu de la relation :
DE = h.c/l
Plus la différence d'énergie est grande, plus la longueur d'onde du maximum d'absorption est faible et plus le nombre d'onde de cette transition est élevé. La méthode de Hückel dans sa
version la plus simple permet de rendre compte de ce phénomène. Il existe une corrélation très nette entre le nombre d'onde du maximum d'absorption mesuré et la différence d'énergie entre la plus haute orbitale moléculaire occupée (HO) et la plus basse vacante (BV) calculées selon la méthode de Hückel, exprimée ici en unités b.
Règles de Woodward-Fieser
Ces règles permettent la prévision de la longueur d'onde du maximum d'absorption des diènes conjugués. Le tableau ci-dessous donne quelques valeurs caractéristiques dans le solvant éthanol mais elles sont pratiquement insensibles à l'influence du solvant.
Pour calculer une longueur d'onde au moyen de cette méthode, on commence par considérer une structure de base :
|
Structure de base |

|
|
|
l de base (nm) |
214 |
253 |
Selon la nature du substituant sur cette structure de base, différents incréments sont ajoutés :
|
Substituant |
Quantité à ajouter par substituant (nm) |
|
double liaison conjuguée
double liaison exocyclique
alkyle, reste de cycle
-NR1R2
-RO
-Cl, -Br
|
30
5
5
60
6
5
|
considérons à titre d'exemple la molécule d'ergostérol précurseur de la provitamine D2 :
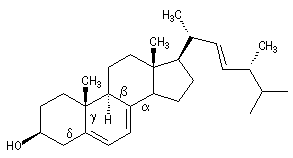
|
base
4 groupes alkyles : a, b, g, d
2 doubles liaisons exocycliques
|
253 nm
20 nm
10 nm
|
| lM (calculée) |
283 nm |
Infrarouge
La conjugaison, par le relâchement de la force des liaisons multiples qu'elle entraîne, se traduit par une diminution des nombres d'onde des absorptions des principaux vibrateurs de l'ordre de 20 cm-1.
Systèmes allyliques
Introduction
Les composés contenant le groupe prop-2-ényle sont appelés traditionnellement composés allyliques.
De nombreux composés à structure allyliques sont connus. Les plus courants sont les halogénures et les alcools. Le rétinol est un alcool allylique qui joue un rôle important dans la chimie de la
vision. L'oxydation des alcools allyliques conduit aux a-énones.
Cations allyliques
Lorsqu'on effectue la solvolyse du 3-chlorobut-1-ène ou chlorure d'a-méthylallyle par un mélange eau-dioxane, on observe que la réaction est du premier ordre par rapport à l'halogénure. On obtient deux alcools I et II. I est le produit de substitution normalement attendu dans ce type de réaction tandis que II possède une structure dans laquelle le squelette carboné a subi une transposition.
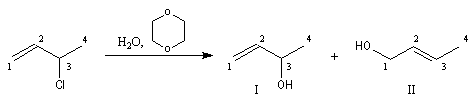
Ces résultats s'interprètent par la formation d'un cation allylique dans lequel la densité électronique est répartie sur trois atomes de carbone contigus. La structure originale de ce système conjugué peut être décrite par la méthode de la mésomérie ou mieux par celle des orbitales moléculaires.
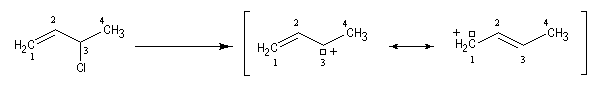
Le carbocation allylique C réagit ensuite avec le nucléophile pour donner les produits observés :
- le premier est le produit d'addition normal ;
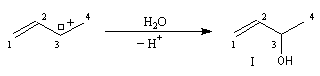
- le second correspond à un produit dans lequel la chaîne carbonée a été modifiée. La substitution s'est accompagnée d'un réarrangement des liaisons. C'est un exemple d'une réaction générale : la transposition
allylique.
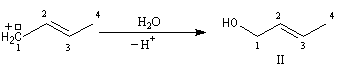
De part leur aptitude à former facilement des carbocations allyliques, les halogénures de cette famille sont particulièrement réactifs vis à vis des réactions de substitution et constituent des substrats utiles en synthèse. La rupture facile de la liaison entre l'atome de
carbone et l'halogène constitue une manifestation de la mobilité allylique.
Mécanisme SN2'
Si l'on traite le 3-chlorobut-1-ène ou chlorure de a-méthylallyle par la triéthylamine, on constate que la réaction possède un ordre global égal à deux : premier ordre par rapport à la triéthylamine et premier ordre par rapport au substrat. Cette loi cinétique ne peut pas s'expliquer par un mécanisme SN1. On obtient 15 % de I et environ 85 % de II.
On interprète ces résultats par le fait que I est le produit de substitution SN2 normal (substitution sur le C2) tandis que II correspond à une réaction du nucléophile sur le C4 qui implique une transposition.
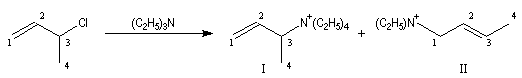
Ce mécanisme particulier est noté SN2' pour marquer sa parenté avec un mécanisme bimoléculaire SN2 "classique" mais il s'accompagne ici d'une transposition. On dit qu'il y a eu renversement de la structure.
Un autre exemple est la réaction entre un organocuprate lithien et un composé allylique par une réaction de substitution de mécanisme SN2'.
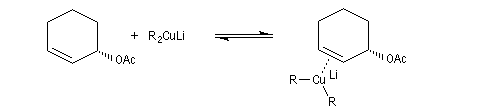
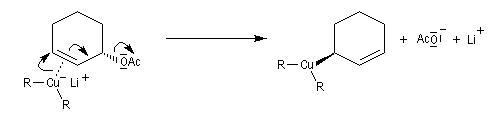
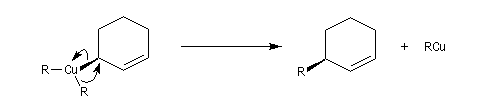
Anions allyliques
On observe une diminution de 10 unités de pKa pour le couple acido-basique quand on passe du propane (pKa = 50) au propène (pKa = 40). Autrement dit, le propène est environ dix milliards de fois plus acide que le propane.
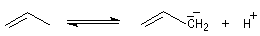
Cet accroissement d'acidité spectaculaire s'explique par l'intervention d'un anion allylique dans le premier cas. Cet anion est beaucoup plus stable qu'un carbanion ordinaire, du fait de la conjugaison électronique, dont on peut rendre compte au moyen de la méthode de la mésomérie, ou mieux, de la méthode des orbitales moléculaires :
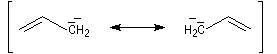
Radicaux allyliques
L'originalité de la structure allylique se manifeste également dans certaines réactions radicalaires. Le N-bromosuccinimide est un réactif permettant la bromation en a de la double liaison des composés éthyléniques. Il libère de très faibles quantités de brome, rendant ainsi négligeable la réaction concurrente d'addition. Cette réaction de bromation allylique est initiée par la lumière
ou par des peroxydes servant d'initiateurs.
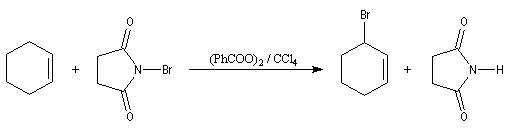
C'est une réaction particulièrement utile car elle permet d'accéder aux dérivés halogénés allyliques qui constituent des substrats très réactifs comme on l'a déja signalé.
La méthode de Hückel appliquée au systèmes allyliques
La méthode de Hückel simple (HMO) constitue une approximation de la théorie des orbitales moléculaires. Le principe de cette théorie a été rappelé dans un chapitre particulier.
Rappelons que les approximations conduisent à prendre :
- les intégrales coulombiennes Hmm égales pour des atomes identiques, par exemple deux atomes de carbone ;
- les intégrales de résonance (intégrales d'échange) Hmn égales entre atomes liés, nulles dans le cas contraire ;
- les intégrales de recouvrement Smn nulles entre atomes différents, tandis que Smm = 1 car les orbitales atomiques
sont normalisées.
Ces approximations sont résumées, avec les notations usuelles, dans le tableau ci-dessous : voir aussi [25].
|
Hmm |
Hmn |
Hmn |
Smn |
|
a |
b (atomes liés) |
0 (atomes non liés) |
dmn |
Dans la méthode LCAO, les orbitales moléculaires ji, sont recherchées comme des combinaisons linéaires d'orbitales atomiques cm.
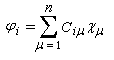
le système des équations séculaires s'écrit :
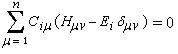
ce système homogène ne possède des solutions non toutes nulles que si :
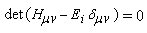
on pose en général :
xi = (a - Ei)/b
Passons à l'étude du système allylique. Sur la forme limite du schéma ci-dessous, l'atome 3 peut être affecté de 0, 1 ou 2 électrons.
La résolution du système d'équations est la même pour tous les systèmes allyliques car la méthode HMO ne fait intervenir que
la position des atomes.
|
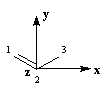
|
Les atomes de carbone et d'hydrogène sont situés dans un même plan. Le système
présente deux plans de symétrie :
- le plan contenant tous les atomes (xOy). Les orbitales p changent de signe dans la réflexion par rapport à ce plan ;
- le plan (yOz), bissecteur de l'angle entre les liaisons C-C, noté P dans la suite. Les orbitales p sont symétriques (S) ou antisymétriques (A) par rapport à ce
plan.
|
On va étudier le cas des systèmes suivants :
On obtient un système de trois équations pour chaque valeur de l'énergie Ei :
(1) Ci1.xi + Ci2 = 0
(2) Ci1 + Ci2.xi + Ci3 = 0
(3) Ci2 + Ci3.xi = 0
Le déterminant séculaire s'écrit :
(xi2 - 2).xi = 0
il y a trois solutions, qui correspondent à trois valeurs de l'énergie, repérées par : i = 1, i = 2, i = 3 : x1 = - 1,41 ; x2 = 0 ; x3 = 1,41
- x1 = -1,41 ; le système s'écrit :
- -1,41 C11 + C12 = 0
- C11 - 1,41 C12 + C13 = 0
- C12 - 1,41 C13 = 0
la condition de normalisation se traduit par :
C112 + C122 + C132 = 1
d'où :
C11 = C13 = 0,5 ; C12 = 0,71
- x2 = 0 ; le système se réduit à deux équations :
la condition de normalisation se traduit par :
C212 + C232 = 1
d'où :
C21 = -C23 = 0,71
- x1 = 1,41 ; le système s'écrit :
- 1,41 C31 + C32 = 0
- C31 + 1,41 C32 + C33 = 0
- C32 + 1,41 C33 = 0
la condition de normalisation se traduit par :
C312 + C322 + C332 = 1
d'où : C31 = C33 = 0,5 ; C32 = -0,71
les valeurs des coefficients des orbitales moléculaires normalisées sont résumés dans le tableau suivant :
|
Energie |
Ci1 |
Ci2 |
Ci3 |
|
E3 = a - 1,41b |
0,5 |
- 0,71 |
0,5 |
|
E2 = a |
0,71 |
0 |
- 0,71 |
|
E1 = a + 1,41b |
0,5 |
0,71 |
0,5 |
les orbitales moléculaires ainsi que leur occupation dans le cas du cation allyle sont représentées ci-dessous :
|
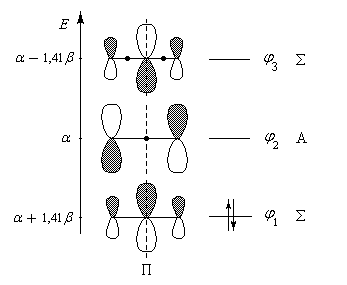
|
|
Diagramme des orbitales moléculaires normalisées du système p du cation allyle. Les orbitales p sont symétriques (S) ou
antisymétriques (A) par rapport au plan P. Par énergie croissante, ces fonctions possèdent respectivement 0, 1, 2 nœuds (point noir)
|
l'occupation des niveaux d'énergie pour les différents systèmes allyliques est donnée ci-dessous :
|
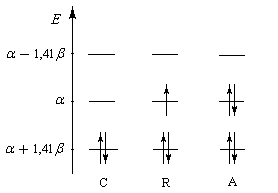
|
|
Occupation des orbitales moléculaires p des systèmes allyliques : cation, radical, anion. Dans le cas du radical, la plus haute orbitale
moléculaire occupée est appelée SOMO (single occupied molecular orbital). |
Dans la méthode HMO, les intégrales de recouvrement entre atomes différents sont toutes nulles. Pour caractériser la population de recouvrement, C. A. Coulson a proposé d'introduire la notion d'indice de liaison p :
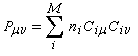
ni est le nombre d'électrons (0, 1, 2) décrits par l'orbitale moléculaire ji. La somme est étendue aux M orbitales occupées. Les résultats pour les systèmes précédents
sont les suivants :
|
Indice de liaison |
P12 |
P23 |
P13 |
|
cation |
0,71 |
0,71 |
0,5 |
|
radical |
0,71 |
0,71 |
0 |
|
anion |
0,71 |
0,71 |
-0,5 |
Dans le cas du cation, on note une valeur non négligeable de P13. On peut l'interpréter comme un témoignage de la formation possible d'un ion cyclopropénium.
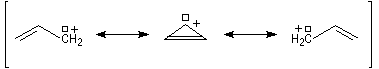
Cet ion aromatique a été préparé par R. Breslow en 1967.
Diènes conjugués
Résultats expérimentaux
Lorsqu'on s'intéresse aux distances interatomiques dans l'éthène, le buta-1, 3-diène et l'éthane, on obtient les résultats suivants :
|
Composé |
Ethène |
Buta-1,3-diène |
Ethane |
|
Distance interatomique |
d(C1C2) = 0,134 nm |
d (C2C3) = 0,148 nm |
d (C1C2) = 0,154 nm |
La longueur de la liaison entre les atomes de carbone C2 et C3 dans la molécule de
butadiène est donc intermédiaire entre celles observées dans l'éthène et dans l'éthane.
L'expérience montre que les conformations privilégiées de la molécule de buta-1, 3-diène sont celles pour lesquelles les atomes sont dans un même plan. Il existe deux conformations planes appelées s-trans (I) et s-cis(II).
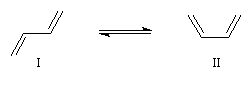 La différence d'énergie entre ces deux conformations peut être évaluée. La conformation s-trans est plus stable d'environ 12 kJ.mol-1 que la s-cis, tandis que l'énergie d'activation pour passer de l'une à l'autre est d'environ 16 kJ.mol-1. A la température
ordinaire, la plupart des molécules de buta-1, 3-diène sont sous la forme s-trans.
La différence d'énergie entre ces deux conformations peut être évaluée. La conformation s-trans est plus stable d'environ 12 kJ.mol-1 que la s-cis, tandis que l'énergie d'activation pour passer de l'une à l'autre est d'environ 16 kJ.mol-1. A la température
ordinaire, la plupart des molécules de buta-1, 3-diène sont sous la forme s-trans.
L'étude des réactions d'hydrogénation et d'addition des hydracides, montre que la molécule de buta-1, 3-diène possède une
réactivité originale par rapport à un composé éthylénique ordinaire.
Ces résultats s'interprètent en utilisant la méthode de la mésomérie. La molécule peut-être considérée comme un hybride des formes limites suivantes :
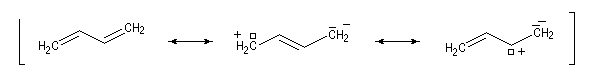
La forme possédant le plus grand poids statistique est la forme 1. La forme 2 indique que dans la molécule réelle, il existe un certain caractère de liaison double entre les atomes
C2 et C3.
Nous allons maintenant utiliser une approche plus fine de la réalité grâce à la méthode des orbitales moléculaires.
Méthode de Hückel appliquée au buta-1, 3-diène
Les principes de la méthode de Hückel ont été rappelés plus haut. La solution du problème est facilitée lorsqu'on considère les
symétries de la molécule.
|
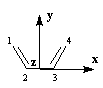
|
Les atomes de carbone et d'hydrogène sont situés dans un même plan. Dans la conformation s-cis, la molécule
présente deux plans de symétrie :
- le plan contenant tous les atomes (xOy). Les orbitales p changent de signe dans la réflexion par rapport à ce plan ;
- le plan (yOz), perpendiculaire à la liaison C2- C3, noté P dans la suite. Les orbitales p sont symétriques (S) ou antisymétriques (A) par rapport à ce
plan.
|
Le calcul conduit aux système de quatre équations ci-dessous :
(1) Ci1.xi + Ci2 = 0
(2) Ci1 + Ci2.xi + Ci3 = 0
(3) Ci2 + Ci3.xi + Ci4 = 0
(4) Ci3 + Ci4.xi = 0
Les solutions de ce système reflètent la symétrie moléculaire. Elles sont symétriques ou bien antisymétriques par rapport au plan P. On peut, dès lors, les classer en deux groupes :
- solutions symétriques : Ci1 = Ci4 ; Ci2 = Ci3
le système d'équations s'écrit :
- Ci1.xi + Ci2 = 0
- Ci1 + Ci2.(xi + 1) = 0
dont le déterminant est : (xi + 1).xi - 1 = 0 ; xi2 + xi - 1 = 0
il y a deux solutions repérées par i = 1 et i = 3 : x1 = - 1,62 ; x3 = 0,62
- solutions antisymétriques :
Ci1 = - Ci4 ; Ci2 = - Ci3
le système d'équations s'écrit :
- Ci1.xi + Ci2 = 0
- Ci1 + Ci2.(xi - 1) = 0
dont le déterminant est : (xi - 1).xi - 1 = 0 ; xi2 - xi - 1 = 0
il y a deux solutions repérées par i = 2 et i = 4 : x2 = - 0,62 ; x4 = 1,62
Les coefficients des orbitales moléculaires et les énergies des niveaux correspondants sont regroupés dans le
tableau suivant :
|
Energie |
Ci1 |
Ci2
|
Ci3
|
Ci4
|
|
E4 = a - 1,62b |
0,37 |
-0,60 |
0,60 |
-0,37 |
|
E3 = a - 0,62b |
0,60 |
-0,37 |
-0,37 |
0,60 |
|
E2 = a + 0,62b |
0,60 |
0,37 |
-0,37 |
-0,60 |
|
E1 = a + 1,62b |
0,37 |
0,60 |
0,60 |
0,37 |
Les représentations des orbitales moléculaires du système P du buta-1, 3-diène sont
données ci-dessous :
|
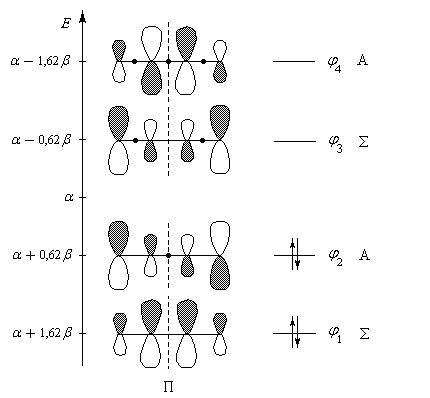
|
|
Diagramme des orbitales moléculaires du système p du buta-1, 3-diène. Les orbitales p sont symétriques (S) ou bien
antisymétriques (A) par rapport au plan P médiateur de la liaison C2-C3. Une autre caractéristique importante des fonctions d'onde est le nombre de nœuds (ou point nodal) qu'elle présentent, c'est à dire de points où la fonction s'annule en changeant de signe. Par énergie croissante, ces fonctions possèdent respectivement 0, 1, 2, 3 nœuds (point noir). On note que le nombre de nœuds croît de une unité quand on passe d'une om à la suivante (règle générale). |
Pour caractériser la population de recouvrement, nous avons vu plus haut qu'on introduit la notion d'indice de liaison p :
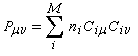
La somme est étendue aux M orbitales occupées.
De nombreuses formules semi-empiriques ont été proposées pour relier la distance internucléaire Rmn à l'indice de liaison p : Pmn. En voici une :
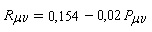
Lorsque Pmn augmente, Rmn diminue.
Pmn est un indicateur de la "force" de la liaison. A partir des coefficients des orbitales moléculaires calculés plus haut, on obtient les résultats suivants :
|
Liaisons |
C1C2 |
C2C3 |
|
Pmn |
0,89 |
0,45 |
|
Rmn (nm) |
0,136 |
0,145 |
La valeur de 0,45 pour l'indice de liaison p entre les atomes de carbone C2 et C3, témoigne d'un recouvrement important entre les orbitales p de ces atomes. Cela correspond à un caractère partiel de liaison double déja évoqué dans la méthode de la mésomérie. Les valeurs calculées des longueurs de liaison sont en bon accord avec les valeurs
expérimentales.
Energie de délocalisation électronique
Comme le montre le bilan énergétique de la réaction d'hydrogénation, un système conjugué comme le buta-1, 3-diène est plus stable qu'un système qui serait constitué de 2 doubles liaisons éthyléniques isolées.
Pour chiffrer l'importance de la conjugaison sur la stabilité de la structure, on introduit la notion d'énergie de résonance électronique. C'est par définition, la différence entre l'énergie du système p et l'énergie de deux doubles liaisons non conjuguées modélisées par des molécules d'éthène :
Ed = Ep - EE
Ep = 2(a + 1,62b) + 2(a + 0,62b) ; Ep = 4a + 4,48b
EE = 2(a + b)
Ed = 0,48b
Ed < 0
Cela correspond bien à une stabilisation du système conjugué par rapport à un système constitué des liaisons non conjuguées. L'énergie de délocalisation électronique
est une grandeur microscopique.
Energie de résonance
Enthalpie d'hydrogénation
L'hydrogénation catalytique du buta-1, 3-diène conduit au butane. Cette réaction n'a pas d'intérêt pratique mais elle est utile pour estimer
le gain de stabilité dû à la conjugaison dans la molécule de buta-1, 3-diène par rapport à une structure non conjuguée.
|
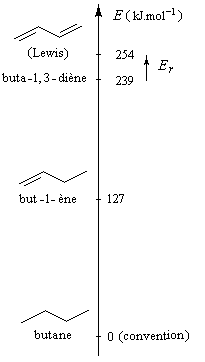
|
L'hydrogénation du buta-1, 3-diène dégage une énergie de -239 kJ.mol-1.
Celle du but-1-ène dégage -127 kJ.mol-1 . On en déduit que l'hydrogénation du but-2-ène à deux doubles liaisons isolées fournirait :
2´ (-127) = -254 kJ.mol-1
L'énergie de résonance est la différence entre l'énergie de buta-1, 3-diène (hypothétique) et celle de la molécule de butadiène réelle. C'est une grandeur positive par définition.
ER = 254 - 239
ER = 15 kJ.mol-1
Cette quantité est une mesure de l'accroissement de stabilité qu'acquiert la molécule de buta-1, 3-diène du fait de son caractère conjugué. |
Addition des hydracides
la réaction d'addition du bromure d'hydrogène HBr sur le buta-1, 3-diène donne deux dérivés bromés isomères : le 3-bromobut-1-ène (1) et le 1-bromobut-2-ène (2). On les appelle traditionnellement produit d'addition 1, 2 et produit d'addition 1, 4.
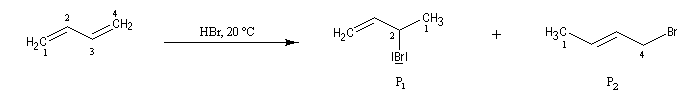
Ces résultats s'interprètent par la formation d'un intermédiaire commun qui est un cation allylique :
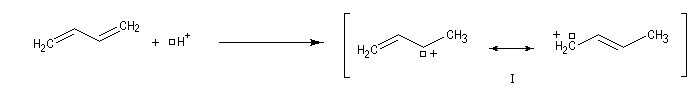
- l'addition de l'ion bromure peut s'effectuer sur l'atome de carbone 2 pour conduire au composé P1 ou produit d'addition 1, 2 ;
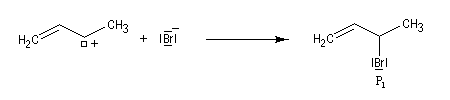
- elle peut aussi s'effectuer sur l'atome de carbone 4 pour donner le composé P2 ou produit d'addition 1, 4.
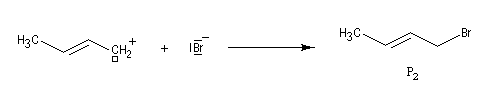
Les pourcentages de produits obtenus dépendent du type de contrôle de la réaction.
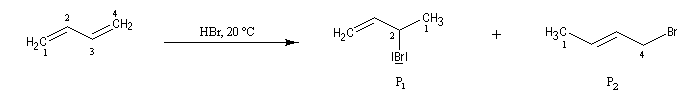
Une étude plus détaillée de la réaction de bromation du buta-1, 3-diène, montre que selon la valeur de la température, les pourcentages des dérivés sont différents. Voici quelques résultats expérimentaux :
|
Température |
0 °C |
40 °C |
|
P1 |
90 % |
10 % |
|
P2 |
15 % |
85 % |
On peut ainsi, en choisissant convenablement la valeur de T obtenir préférentiellement un composé ou son isomère :
- à la température de 0 °C, la réaction est sous contrôle cinétique. Le produit majoritaire est le plus rapidement formé. C'est P1 car l'état de transition qui y conduit est celui qui possède l'enthalpie libre molaire d'activation la plus basse ;
- à température plus élevée, la réaction passe sous contrôle thermodynamique. Les produits P1 et P2 sont alors en équilibre via le carbocation allylique I. Le produit majoritaire est alors le plus stable. C'est P2 car DrG 2* < DrG 1*.
Ces résultats sont regroupés sur le diagramme énergétique ci-dessous :
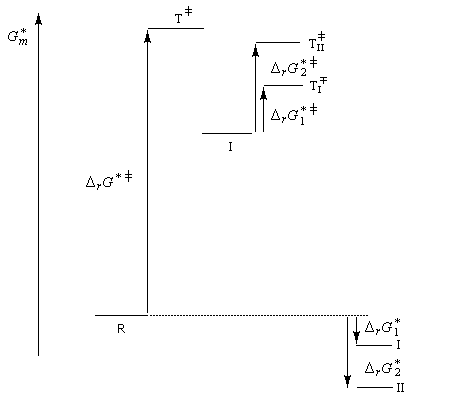
En vertu du principe de réversibilité microscopique, le chauffage du composé P1 doit conduire à son isomérisation en P2
en empruntant le chemin réactionnel inverse de celui qui a conduit à sa formation. C'est bien ce qu'on observe expérimentalement.
Réaction de Diels-Alder
Introduction
Lorsqu'on chauffe un mélange d'éthène et de butadiène à 200 °C, on obtient un mélange de cyclohexène et de 4-vinylcyclohexène. La transformation s'interprète par deux réactions :
- la première fournit du cyclohexène ;
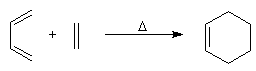
- la seconde conduit au 4-vinylcyclohexène qui est le produit majoritaire.
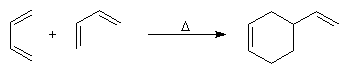
L'expérience, réalisée par O. Diels et son élève K. Alder en 1928, constitue un exemple d'une réaction de cycloaddition entre un diène et un composé éthylénique appelé philodiène, qui s'effectue selon une voie thermique. Elle porte le nom de réaction de Diels-Alder en souvenir de ses auteurs qui ont obtenu le prix Nobel en 1950 pour cette découverte [37].
L'importance de la réaction de Diels-Alder vient du fait qu'elle est généralisable aux alcènes et aux diènes fonctionnalisés.
On peut ainsi accéder aux cyclohexènes substitués qui constituent une partie du squelette de nombreuses molécules complexes. Un exemple est celui de plusieurs synthèses de la molécule de cantharidine pour lesquelles la réaction de Diels-Alder constitue l'étape clé.
Cette réaction a fait l'objet d'un nombre considérable d'études tant d'un point de vue expérimental que théorique. La réaction de Diels-Alder a trouvé une interprétation particulièrement élégante dans la théorie de la conservation de la
symétrie des orbitales développée par les chimistes américains R. B. Woodward et R. Hoffmann que ces derniers ont mise en évidence dans l'étude des réactions électrocycliques [30], [31],[32] au cours de la synthèse de la vitamine B12. La réaction de Diels-Alder constitue aussi un bel exemple du rôle joué par les orbitales frontières des réactifs, théorie développée par le chimiste japonais K. Fukui [75] . Ce dernier et R. Hoffmann se sont partagés le prix Nobel de chimie en 1981 [38].
Pour une présentation générale des applications de la réaction de Diels-Alder en synthèse organique, voir l'article de K. C. Nicolaou [46].
Propriétés générales
La réaction est facilitée si l'un des partenaires (généralement le philodiène) porte un ou plusieurs groupes attracteurs d'électrons. Par exemple avec un nitroalcène comme diènophile.
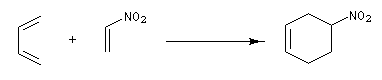
Notons que les nitro-alcènes peuvent être assez facilement obtenus par déshydratation des b-nitro-alcools obtenus par la réaction nitro-aldol (réaction de Henry).
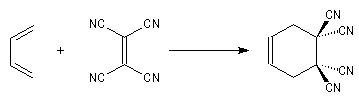
Le tétracyanoéthylène (TCNE) est l'un des meilleurs philodiènes connus.
Elle est également facilitée si l'un des partenaires (généralement le diène) porte des groupes donneurs d'électrons.
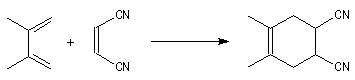
Dans ces réactions, le diène réagit dans la conformation s-cis (II) bien que celle-ci soit moins stable que
la conformation s-trans (I). En effet, le passage d'une conformation à l'autre ne nécessitant qu'une faible énergie, le principe de Curtin-Hammett indique que le pourcentage de produit n'est pas déterminé par le rapport des populations des conformations.
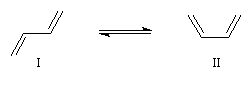
La consommation du diène par la réaction d'addition, permet le déplacement de l'équilibre d'isomérisation.
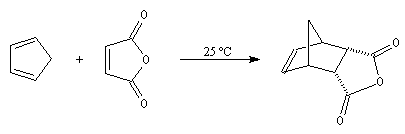
Les diènes cycliques comme le cyclopentadiène possèdent des doubles liaisons dans une configuration Z favorable et ils réagissent
généralement plus rapidement que leurs homologues acycliques.
Le benzyne constitue un bon diénophile dans les réactions de Diels-Alder.
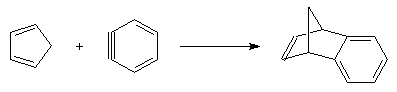
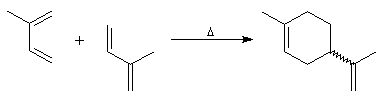
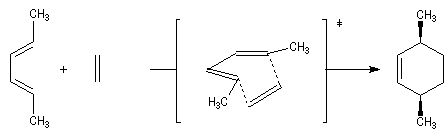
Dans une réaction de dimérisation, l'une des molécules joue le rôle de diène tandis que l'autre joue le rôle de diénophile. Nous avons déja cité la synthèse du 4-vinylcyclohexène et celle du dicyclopentadiène. La réaction suivante, qui conduit au mélange racémique des R et S limonènes, constitue un autre exemple. Le diène possède la conformation s-cis tandis que le diénophile a une conformation s-trans.
L'anthracène donne une réaction de Diels-Alder avec le TCNE.
Les quinones sont de bons diénophiles dans les réactions de Diels-Alder et elles ont été utilisées dans les premières
synthèses de stéroïdes.
La réaction peut être utilisée pour synthétiser certains hétérocycles. L'exemple suivant concerne une préparation du dihydropyrane (DHP) : un éther d'énol.
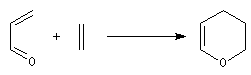
La réaction peut également avoir lieu de façon intramoléculaire. En voici un exemple, extrait d'une synthèse récente.
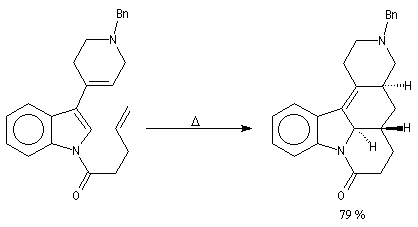
Comme on le verra en détail un peu plus loin, la réaction de Diels-Alder est une réaction stéréospécifique. Cette stéréospécificité s'exprime à la fois par rapport au diène et par rapport au diénophile. La géométrie de l'addition est syn.
Réaction de rétro Diels-Alder
La réaction intermoléculaire est renversable. Elle est en effet exothermique (2 liaisons p sont remplacées par deux liaisons s) et elle a une entropie de réaction négative (état initial plus désordonné que l'état final). Ainsi, lorsqu'on élève la température, il est possible d'observer la réaction inverse au delà de la température d'inversion de l'équilibre.
Celle-ci est appelée rétro Diels-Alder.
|

|
Le cyclopentadiène peut être préparé par craquage thermique du dicyclopentadiène à 150 °C. Cette réaction intervient dans la synthèse du ferrocène [3].
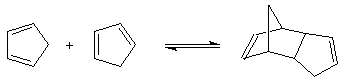
|
Ce caractère renversable de la réaction de Diels-Alder, explique l'échec de la synthèse de la cantharidine par réaction entre le furane et un
dérivé diméthylé de l'anhydride maléique.
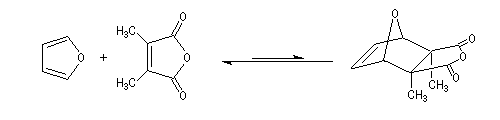
Interprétation orbitalaire
L'addition entre le butadiène et l'éthène ne peut pas s'interpréter par un contrôle de charge car les réactifs impliqués sont électriquement neutres. Par ailleurs, l'expérience montre que la réaction est concertée c'est à dire que des liaisons sont rompues et
d'autres reformées sans qu'il y ait passage par un composé intermédiaire. Woodward et Hoffmann ont proposé d'appeler péricycliques les réactions concertées dans lesquelles les liaisons sont formées et rompues dans un état de transition cyclique [24]. La réaction de Diels-Alder appartient à cette catégorie. (pour une revue de ces réactions, voir [32].)
Plus précisément, il s'agit d'une cycloaddition mettant en jeu 4 électrons pour le premier réactif et 2 pour le second c'est pourquoi on l'appelle cycloaddition [4 + 2].
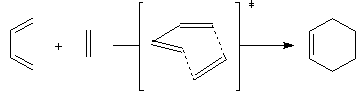
La formation des liaisons, est à la fois supra pour le diène et pour le diénophile. Il s'agit donc d'une réaction réaction de type [p4s + p2s ]. Cette
approche des atomes permet d'expliquer la stéréospécificité de la réaction. On trouvera sur le site [43], de remarquables simulations
permettant de visualiser le mode d'approche des réactifs.
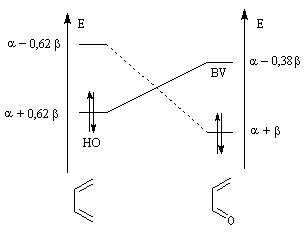
Le diagramme ci-dessous montre les interactions entre les orbitales frontières du buta-1, 3-diène et de l'éthène. Les recouvrements s'effectuent entre les orbitales des atomes situés aux extrémités des molécules. Ils impliquent les lobes de même signe ce qui se traduit sur le diagramme par une même couleur.
|
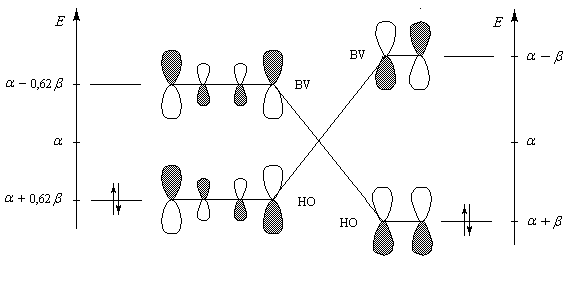
|
|
Diagramme montrant l'interaction entre les orbitales frontières du butadiène et de l'éthylène dans la
réaction de Diels-Alder. |
Aspect cinétique
Expérimentalement, on constate que la constante de vitesse de la réaction croit lorsque l'un des partenaires est appauvri en électrons tandis que l'autre est au contraire enrichi en électrons. Le tableau ci-dessous regroupe quelques valeurs de la
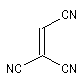
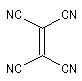
constante de vitesse pour la réaction suivante entre le cyclopentadiène et l'acrylonitrile.
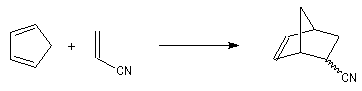
|
Diénophile |
|
|
|
 |
|
k |
1 |
45,5´103 |
48,0´104 |
43,0´106 |
Ces résultats s'interprètent dans le cadre d'un contrôle cinétique de la réaction si l'on admet que celle-ci fait intervenir l'interaction entre la HO et la BV les plus proches en énergie.
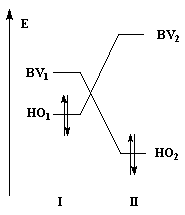
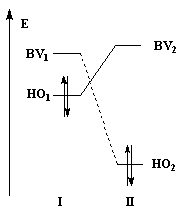
Examinons l'influence de la substitution sur les interactions entre HO et BV pour deux systèmes respectivement non substitué et substitué.
Dans les diagrammes ci-dessous, (I) est substitué par un groupe donneur d'électrons tandis que (II) est substitué par un groupe attracteur :
|
|
|
|
Système non substitué : les différences entre les niveaux d'énergie des orbitales frontières des molécules (I) et (II) sont les mêmes. |
Système substitué : l'énergie de la HO de (I) est relevée ; celle de la BV de (II) est abaissée. L'écart le plus faible entre les orbitales frontières met en jeu la HO de (I) et la BV de (II). |
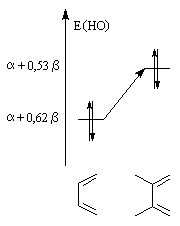
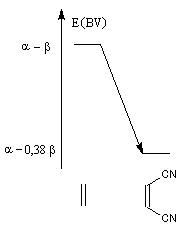
Dans l'exemple ci-dessous, l'influence de la substitution sur les niveaux d'énergie de la HO du diène et la BV du diénophile peut être évaluée simplement
au moyen de la méthode de Hückel.
|
|
|
|
Influence de la substitution du buta-1, 3-diène par deux groupes méthyle en 2 et 3 sur le niveau de la HO. |
Influence de la substitution de l'éthène par deux groupes cyano sur le niveau de la BV. |
Plus généralement, l'interaction prédominante entre les orbitales frontières fait intervenir la plus petite différence d'énergie entre la HO de l'un des partenaires et la BV de l'autre. Cela peut correspondre à deux situations :
Régiosélectivité
Lorsque le diène et le diénophile ne sont pas substitués de manière symétrique, deux adduits peuvent se former. Dans l'exemple ci-dessous
les adduits (I) et (II) sont appelés respectivement ortho et méta par référence
à la chimie des cycles benzéniques.
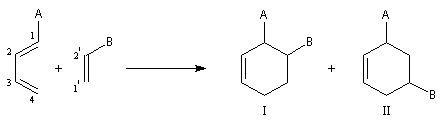
Prenons comme exemple le diène X et le diénophile Y ci-dessous :
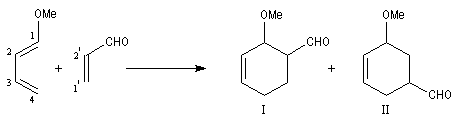
L'expérience montre que I est le produit unique de la réaction.
Lorsque le diène est substitué par un groupe donneur et le diénophile par un groupe attracteur, l'interaction prédominante
fait intervenir la plus haute orbitale occupée du diène et la plus basse orbitale vacante du
diénophile. La régiosélectivité peut être prévue en partant de l'idée que les liaisons s'effectuent entre les atomes de
carbone possédant les coefficients les plus élevés dans ces orbitales.
|
Formules |
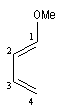
|
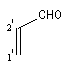
|
|
Composés |
X |
Y |
Les énergies des orbitales frontières du diène et les coefficients des atomes de carbone de ces
orbitales sont donnés ci-dessous :
|
Energie |
C1 |
C2
|
C3
|
C4
|
| |
|
EHO = a + 0,46b |
0,50 |
0,47 |
-0,28 |
-0,60 |
|
EBV = a - 0,71b |
0,61 |
-0,29 |
-0,41 |
0,58 |
de même pour le diénophile ;
|
Energie |
C'1 |
C'2 |
|
EHO = a + b |
-0,58 |
-0,58 |
|
EBV = a - 0,35b |
-0,66 |
0,26 |
les liaisons vont se former préférentiellement entre les atomes : C1 (0,50) - C2' (0,26)
et C4 (-0,60) - C1' (-0,66) conduisant au produit ortho.
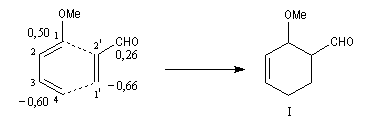
Stéréospécificité
Le caractère syn de l'addition entre le diène et le diénophile entraîne la stéréospécificité.
Celle-ci s'exprime doublement. Par rapport aux diène et par rapport au diénophile :
- stéréospécificité par rapport au diénophile ;
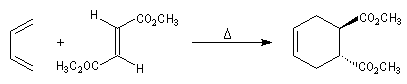
- stéréospécificité par rapport au diène ;
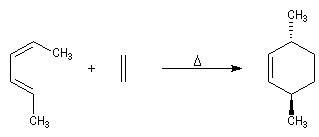
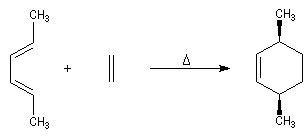
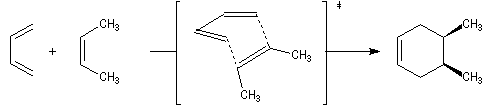
Ces résultats s'interprètent par un état de transition dans lequel le diène et le diénophile sont dans
des plans parallèles.
Règle d'Alder
Lorsqu'on réalise une réaction de Diels-Alder entre un diène cyclique comme le cyclopentadiène
et un dérivé substitué de l'éthène, deux adduits diastéréo-isomères I et II peuvent se former. Traditionnellement, on utilise une nomenclature propre aux composés bicycliques pontés. I est appelé composé
endo tandis que II est appelé composé exo.
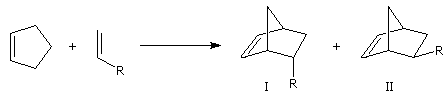
|
|
 |
|
Stéréoisomère endo : le groupe R est dirigé vers l'intérieur de la molécule, du côté opposé au pont le plus petit. |
Stéréoisomère exo : le groupe R est dirigé vers l'extérieur de la molécule du même côté que le pont le plus petit.
|
Examinons les résultats expérimentaux dans le cas de la réaction sous contrôle cinétique entre le cyclopentadiène et l'acrylate de méthyle.
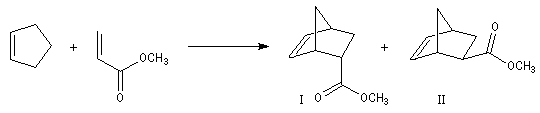
|
Composé |
endo |
exo |
|
Pourcentage |
78 |
22 |
Ces résultats peuvent être interprétés si l'on admet que dans le cadre d'un contrôle cinétique, la stéréochimie est gouvernée
par le recouvrement des orbitales frontières des réactifs. Lors de la formation de l'adduit endo, on a les recouvrements suivants :
- recouvrement principal : C1-C3' et C4-C2' ;
- recouvrement secondaire : C2-O et C3-C1'.
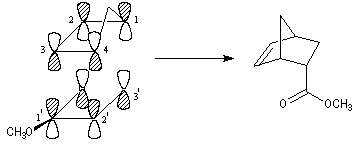
voici d'autres exemples :
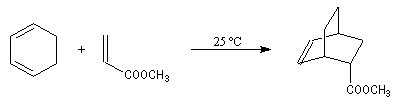
L'anhydride maléique est un excellent diénophile. L'adduit obtenu qui possède l'équivalent de deux fonctions acides est ensuite susceptible de fournir plusieurs produits intéressants.
 Les résultats précédents sont valables dans le cadre d'un contrôle cinétique. Si la réaction est effectuée sous contrôle thermodynamique, on obtient généralement l'adduit exo, plus stable que l'endo.
Réactions de Diels-Alder catalysées par des acides de Lewis
Les résultats précédents sont valables dans le cadre d'un contrôle cinétique. Si la réaction est effectuée sous contrôle thermodynamique, on obtient généralement l'adduit exo, plus stable que l'endo.
Réactions de Diels-Alder catalysées par des acides de Lewis
Le substrat est un ester du menthol. Ce dernier est utilisé comme auxilliaire chiral. L'acide de Lewis est le tétrachlorure de titane. Le produit est obtenu avec un excès énantiomérique de 90 %.
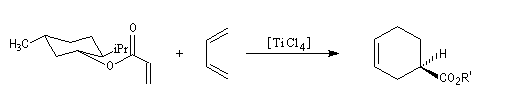
Après réduction de l'ester, l'alcool correspondant est utilisé dans la synthèse de la (-)-(R)-sarkomycine.
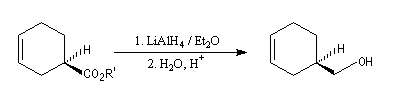
Synthèse du patchoulol
|
|
Le patchoulol est un alcool de formule brute C15H26O. Il est issu de l’huile essentielle d’une famille de plantes, les patchoulis, voisines des menthes. Il est utilisé en parfumerie [57]. L'oxyde de patchoulène
qui peut être obtenu assez facilement à partir du patchoulol, a été utilisé comme composé de départ par R. A. Holton dans sa remarquable synthèse du taxol en 1994 [59].
|
La réaction suivante entre le diméthyl-1,3-cyclohexadiène et la but-3-èn-2-one, constitue le point de départ de la synthèse du patchoulol.
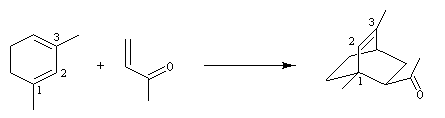
Synthèse du taxol
|
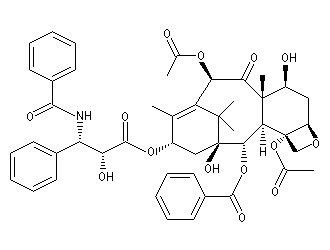
|
Le taxol (paclitaxel) est une substance extraite de l'écorce de l'If du pacifique (Taxus brevifolia), possédant des propriétés anticancéreuses. Il a été découvert en 1962 par le botaniste américain Arthur Barclay qui participait à un criblage de substances naturelles dans les forêts de l'Ouest américain dans le cadre d'un programme institué par le National Cancer Institute (NCI).
La molécule a été isolée en 1971 à partir de l'écorce de l'If du pacifique par les chimistes Wall, Wani et Taylor. Il faut 1 kg d'écorce pour isoler 100 mg de produit actif. Une production à grande échelle à partir de cette seule source est donc difficile à envisager. C'est en essayant d'extraire des analogues du Taxol issus de l'if européeen que les chercheurs de l'Institut de chimie des substances naturelles de Gif sur Yvette on découvert le taxotère.
La complexité de la molécule de taxol (la molécule possède 11 centres chiraux) a constitué un challenge pour de nombreuses équipes. Quelques étapes de la synthèse de K. C. Nicolaou sont décrites ci-dessous [80] (voir aussi : [46] et [58].
Signalons un autre médicament anticancéreux mis au point par la même équipe de l'ICSN : la Navelbine
|
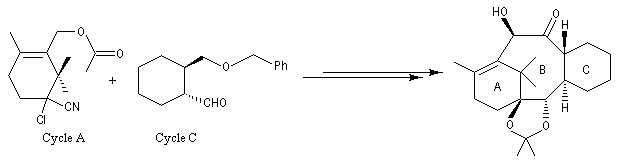
La synthèse de K. C. Nicolaou s'appuie sur la préparation du composé bicyclique "ABC". Les cycles A et C sont obtenus au moyen de deux réactions de Diels-Alder selon le plan ci-dessous.
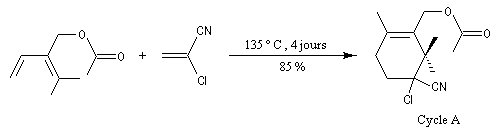
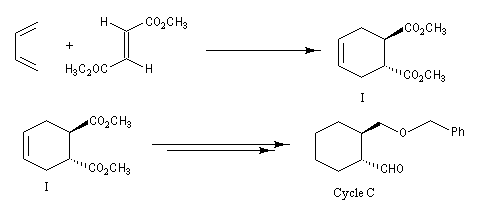
Les cycles A et C sont ensuite réunis au moyen de la réaction de couplage de Mac-Murry.
Synthèse du cubane
Cette synthèse, réalisée par J. C. Barborak, L. Watts et R. Petitt de l'Université du Texas en 1966, débute par une addition de Diels-Alder. Le diène est le cyclobutadiène
provenant de la décomposition d'un complexe que Petitt avait préparé quelque temps auparavant.
Le philodiène est un dérivé dibromé de la parabenzoquinone.
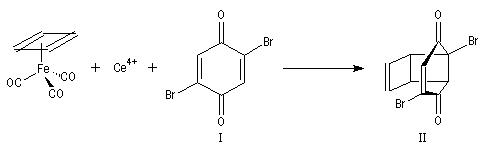
L'adduit de Diels-Alder subit une réaction de cyclisation photochimique.
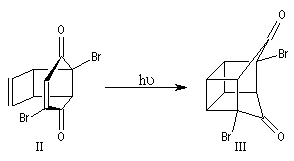
Le squelette de la molécule recherchée est obtenu grâce à une double transposition de Favorskii.
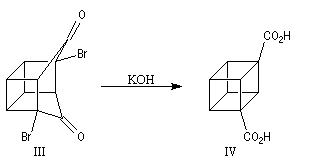
La fin de la synthèse comporte une suite de réactions qui se traduisent globalement par une décarboxylation.
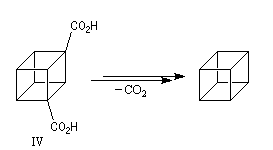
Notons que la première synthèse du cubane a été réalisée par P. E. Eaton et T. W. Cole de l'Université de Chicago en 1964. On en trouvera les grandes lignes ainsi que
quelques-unes des propriétés remarquables de cette molécule, à la référence [27].
Addition [4+2] de l'oxygène singulet
L'oxygène singulet joue le rôle de diénophile dans une réaction de cycloaddition [4 + 2] avec les diènes. Cette réaction est apparentée à la réaction de Diels-Alder.
La réaction entre l'oxygène singulet et un diène fournit un composé comportant une liaison peroxo.
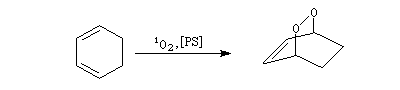
Cette réaction est utilisée comme étape clé dans la synthèse de Schenk de la cantharidine.
|
|
La cycloaddition de l'oxygène singulet permet la synthèse de l'ascaridole, un composé présent dans l'huile de chenopodium, à partir de l'a-terpinène.
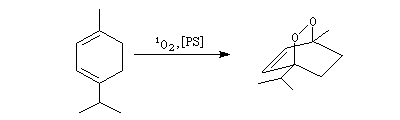
|
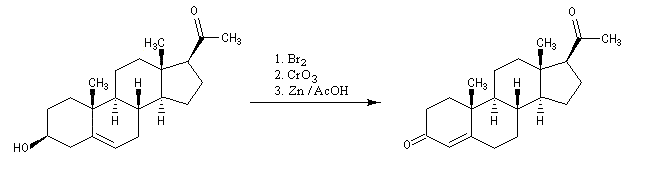
Hémisynthèse de la progestérone
|

|
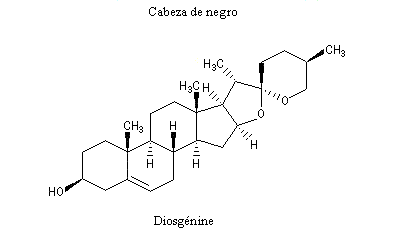
La progestérone, une hormone stéroïde, a été isolée en 1934. La première hémisynthèse efficace de la progestérone a été réalisée en 1941 par le chimiste américain Russel E. Marker (Université de Pennsylvanie) en utilisant un procédé de dégradation de la diosgénine, une molécule d'origine naturelle extraite des tubercules d'une dioscorée mexicaine (appelée : cabeza de negro) [60].
Russel E. Marker (Université de Pennsylvanie) fonda en 1944 le laboratoire pharmaceutique Syntex SA (contraction de synthèse et mexique) dans le but de commercialiser la progestérone obtenue par son procédé de dégradation de la diosgénine. Cette firme fait désormais partie du groupe chimique et pharmaceutique Helvétique Roche depuis 1994.
|
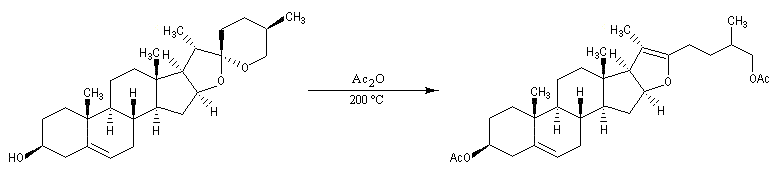
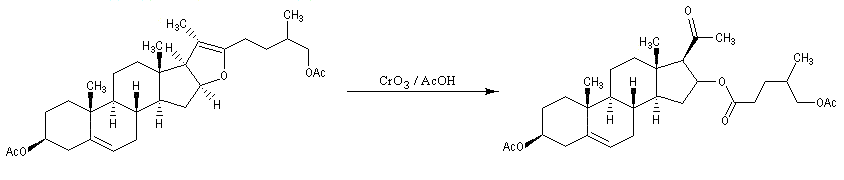
L'oxydation par le trioxyde de chrome provoque la coupure de la double liaison éthylénique.
Le traitement en milieu basique provoque la saponification de l'ester. La molécule obtenue est un aldol qui subit une crotonisation. On obtient une a-énone.
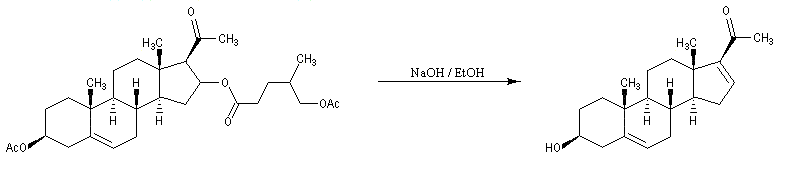
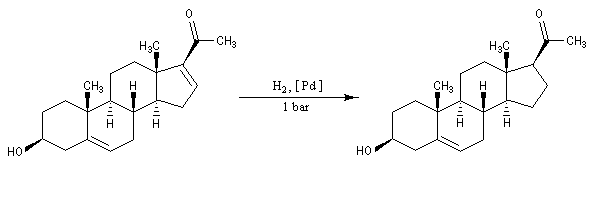
Par hydrogénation catalytique en présence de Pd, la double liaison la plus dégagée stériquement est la plus rapidement hydrogénée.
Le rôle du dibrome est d'effectuer la protection de la double liaison éthylénique au cours de l'oxydation de la fonction alcool par le trioxyde de chrome. La déprotection est effectuée sous l'action du zinc. La présence d'acide permet l'isomérisation du composé obtenu en cétone conjuguée plus stable.
Polymérisation
Polymérisation du butadiène
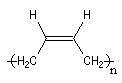
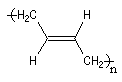
La polymérisation des diènes est, dans son principe, analogue à celle des autres composés éthyléniques. La présence de deux doubles liaisons offre des possibilités supplémentaires dans l'enchaînement des monomères.
Ainsi, la polymérisation du buta-1, 3-diène peut fournir trois polymères différents :
- la polymérisation 1, 2 est celle d'un monomère vinylique ordinaire ;
- la polymérisation 1, 4 pose un problème stéréochimique du fait de la diastéréo-isomérie Z, E dont l'origine est la présence des doubles liaisons éthyléniques dans le polymère. Deux composés peuvent être obtenus :
|
|
|
|
Z |
E |
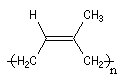
Polymérisation de l'isoprène
La polymérisation de l'isoprène est analogue dans son principe à celle du buta-1, 3-diène. A côté
de la polymérisation 1, 2, on peut obtenir deux types de polymères 1, 4 :
|
|
|
|
Z |
E |
Le caoutchouc naturel provient de la polymérisation naturelle stéréorégulière, catalysée par des enzymes, de l'isoprène. On trouve ce dernier dans le latex, produit par l'écorce de l'hévéa ou arbre à caoutchouc.
Le caoutchouc naturel est le (Z)-polyisoprène-1, 4. Dans son beau livre les objets fragiles [23], P.-G de Gennes raconte comment la polymérisation naturelle de l'isoprène était mise à profit par les Indiens d'Amazonie pour se confectionner des bottes sur mesure.
Comme la molécule obtenue possède encore des liaisons doubles, il est possible de relier les chaînes entre-elles par des ponts. La formation de tels ponts intermoléculaires en présence d'une petite quantité de soufre s'appelle vulcanisation. Ce procédé, qui intervient dans la fabrication de pneumatiques, a été découvert par l'inventeur américain Charles Goodyear en 1839.
Les liaisons pontales diminuent le comportement plastique et augmentent le caractère élastique.
Dans les pneumatiques pour automobiles, on ajoute du carbone au caoutchouc vulcanisé pour augmenter la résistance de la gomme à l'abrasion.
Si la quantité de soufre est plus importante, on obtient un composé de couleur noire qui ne possède plus aucune propriété élastique, l'ébonite, dont la couleur rappelle celle de l'ébène et dont sont constituées les boules de bowling.
La polymérisation de l'isoprène peut être réalisée en utilisant des catalyseurs de Ziegler et Natta [43]. Elle conduit au (Z)-polyisoprène-1, 4 dont la structure est identique à celle du caoutchouc naturel. Le (E)-polyisoprène-1, 4 appelé gutta-percha, ne possède pas de propriétés élastiques. Il intervient dans la fabrication des balles de golf.
Polymères conjugués
Polyacétylène
La synthèse du polyacétylène a été vue dans le chapitre consacré aux alcynes. La structure du polyacétylène mérite quelques commentaires. On peut décrire la molécule par l'alternance de
liaisons simples et de liaisons doubles. Ces liaisons ont des longueurs inégales. Les liaisons doubles sont plus courtes que les liaisons simples. Cette structure particulière, si on la compare à celle où les liaisons auraient une longueur égale, est la conséquence d'une distorsion comparable à l'effet pseudo Jahn-Teller
décrit à propos du cyclobutadiène. Elle porte le nom de distorsion de Peierls. Dans la méthode de Hückel, on considère
deux intégrales de recouvrement :
- b1 associée aux liaisons longues (simples) ;
- b2 associée aux liaisons plus courtes (doubles).
Avec : b2 < b < b1. Le calcul montre qu'on obtient deux bandes (voir aussi a un niveau élémentaire la formule de Coulson pour les om des polyènes) :
- la bande de valence est pleine avec un niveau de Fermi de valeur : a + (b2 - b1) ;
- la bande de conduction est vide.
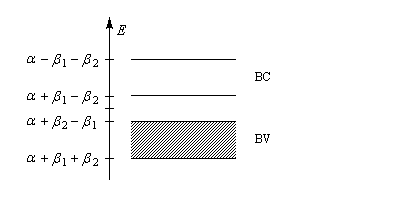
La largeur de la bande interdite est : 2(b1 - b2). Dans les conditions ordinaires, le polyacétylène a les propriétés d'un semi-conducteur.
Il est possible de faire apparaître des charges électriques
dans la structure du polyacétylène. Cette création de charge s'appelle dopage. Les premiers exemples de dopage de polymères comme le polyacétylène ont mis à profit des réactions d'oxydoréduction :
- par oxydation on obtient un dopage de type p
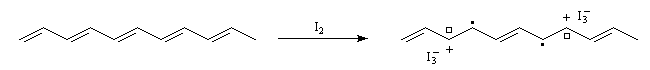
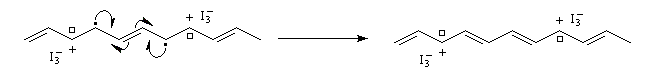
- par réduction au moyen d'un réducteur puissant comme le radical-anion naphtalène-sodium, on obtient un dopage de type n.
Le dopage modifie complètement les propriétés du polymère. Lorsque le niveau de dopage est suffisant elles tendent à ressembler à celles d'un métal.
a-énones
Les a-énones sont des substrats intéressants en synthèse organique car ils donnent lieu à des réactions variées. On les obtient
par plusieurs voies. Citons en quatre :
Exemples d'a-énones
|
|
Le 3-hydroxybutanal ou aldéhyde crotonique est obtenu par déshydratation de l'aldol de l'éthanal.
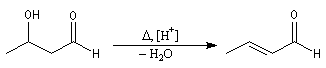
C'est un composé lacrymogène et toxique. Par hydrogénation ménagée il fournit le butanal. L'hydrogénation plus poussée fournit le butan-1-ol.
|
|
|
Le 4-méthylpent-3-éne-2-one ou oxyde de mésityle est obtenu facilement par déshydratation du cétol
de la propanone en milieu acide ou en présence d'une trace de diiode.
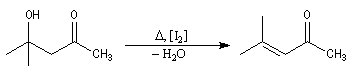
L'hydrogénation de l'oxyde de mésityle conduit à la méthylisobutylcétone, utilisée comme solvant des peintures et vernis.
|
|
|
Le propénal ou acroléine est obtenu industriellement par oxydation ménagée du propène
en présence de catalyseurs au molybdène ou en présence d'oxyde de cuivre (I).
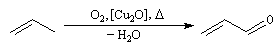
Il possède une odeur âcre. Il se forme par décomposition des graisses (oléines) d'où son nom : acroléine. Il intervient dans plusieurs synthèses industrielles comme celle des amino-acides D et L méthionine. Il est également utilisé dans la préparation du glycérol.
|
Il existe de nombreux aldéhydes et cétones a, b-éthyléniques dans la nature. Le rétinal intervient dans la chimie de la vision. Les irones [55] sont responsables de l'odeur et de la couleur de nombreuses fleurs.
|

|
La jasmone est une a-énone contenant un cycle pentagonal et une chaîne latérale de stéréochimie Z. On la trouve à l'état naturel dans le jasmin.
La molécule de jasmone possède la structure ci-dessous :
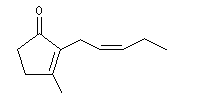
|
De nombreuses synthèses de ce composé ont été proposées :
Dans la synthèse de Büchi, un dérivé du furane est utilisé comme précurseur d'un dérivé dicarbonylé 1,4 qui subit ensuite une cétolisation.
Structure électronique
Les a-énones sont des composés conjugués qui possèdent deux conformations remarquables. En raisonnant par
analogie avec le cas du buta-1, 3-diène, on peut prévoir que la conformation privilégiée du propénal est la forme s-trans.
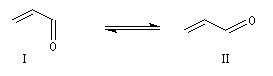
Dans le cas de l'oxyde de mésityle, la conformation s-cis est plus stable que la s-trans à cause de la répulsion entre les méthyles dans cette dernière. On note d'ailleurs
un écart à la planéité avec un angle dièdre d'environ 38° tout à fait visible sur le modèle de la molécule obtenu par minimisation de l'énergie.
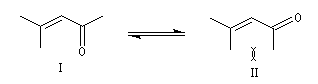
Le propénal est le plus simple des aldéhydes a, b-éthyléniques. La structure peut être décrite par la méthode de la mésomérie :
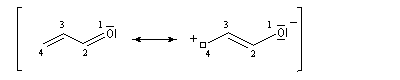
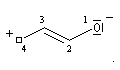
une approche plus précise consiste à étudier le système p par la méthode de Hückel. Utilisons la numérotation suivante pour les différents atomes :
les orbitales moléculaires ji, associées aux énergies Ei ont l'expression suivante en fonction des orbitales atomiques cm :
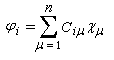
le calcul des coefficients par la méthode de Hückel conduit aux résultats ci-dessous :
|
Energie |
Ci1 |
Ci2
|
Ci3
|
Ci4
|
|
E4 = a - 1,55b |
0,25 |
-0,60 |
0,65 |
-0,42 |
|
E3 = a - 0,38b |
0,44 |
-0,56 |
-0,25 |
0,66 |
|
E2 = a + 0,99b |
-0,58 |
-0,3 |
0,48 |
0,58 |
|
E1 = a + 1,91b |
0,66 |
0,58 |
0,42 |
0,22 |
Les atomes de carbone et d'oxygène contribuent au système p, chacun pour un électron. Il y a au total 4 électrons. La plus haute
orbitale occupée du système p est donc j2. La plus haute orbitale moléculaire occupée de la molécule (HO) est la paire
non liante de l'atome d'oxygène qui n'est pas prise en compte dans le calcul selon Hückel. La plus basse orbitale moléculaire vacante de la molécule (BV) est
j3.
La charge électronique qm de l'atome m, est définie par :
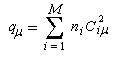
ni est le nombre d'électrons (0, 1, 2) qui sont décrits par l'orbitale moléculaire ji. La somme est étendue aux M orbitales moléculaires occupées.
La charge nette de l'atome m est la différence entre le nombre mm d'électrons apportés au système par cet atome et sa charge électronique :
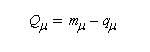
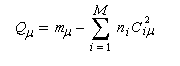 mm = 1 pour C et O. Les charges nettes des différents atomes dans l'orbitale BV sont données ci-dessous :
mm = 1 pour C et O. Les charges nettes des différents atomes dans l'orbitale BV sont données ci-dessous :
|
Q1 |
Q2 |
Q3 |
Q4 |
|
-0,54 |
0,33 |
-0,03 |
0,23 |
ces calculs conduisent aux conclusions suivantes :
- un nucléophile dur, réagira sous contrôle de charge sur l'atome de carbone 2 qui développe la plus grande
densité électronique ;
- un nucléophile mou, réagira de préférence sous contrôle orbitalaire sur l'atome qui possède le plus gros coefficient dans la BV c'est à dire sur l'atome de carbone 4.
Spectroscopie ultraviolette
Les transitions en ultraviolet des composés carbonylés non conjugués ont été évoquées dans le chapitre correspondant. Le spectre du 4-méthylpent-3-én-2-one ou oxyde de mésityle (solvant éthanol) est représenté ci-dessous :
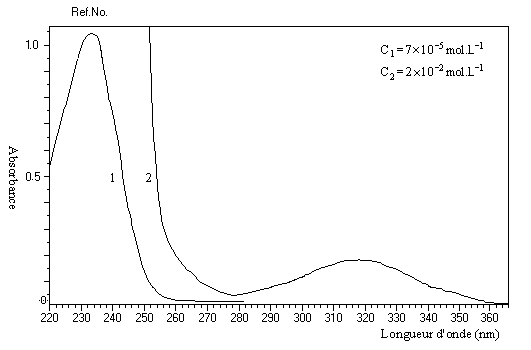
Par rapport à un carbonylé non conjugué comme la propanone, on observe un déplacement des transitions p ® p* et n ® p* vers les grandes longueurs d'ondes (effet bathochrome).
|
Composés |
transition p ® p* |
transition n ® p* |
|
propanone |
188 nm |
279 nm |
|
oxyde de mésityle |
236 nm |
315 nm |
Règles de Woodward
Les règles de Woodward permettent la prévision de la longueur d'onde du maximum d'absorption de la
transition p ® p*. Les incréments à ajouter à la longueur d'onde de base dépendent de la position
des substituants sur la structure et de sa nature. Les positions sont représentées par les lettres a, b, g, d :
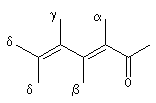
|
structure de base |
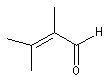
|
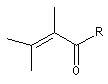
|
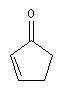
|
|
|
l de base (nm) |
207 |
215 |
202 |
215 |
|
substituant |
quantité à ajouter par substituant (nm) |
|
double liaison exocyclique
conjugaison supplémentaire
diène homoannulaire
|
5
30
39
|
|
position des substituants |
a |
b |
g |
d |
|
-R, -RO, -CH3CO2,
-PhCO2 |
10 |
12 |
18 |
18 |
|
-OH |
35 |
30 |
- |
50 |
|
-Br |
25 |
30 |
- |
- |
Déterminons à titre d'exemple, la longueur d'onde du maximum d'absorption pour l'oxyde de mésityle :
à la valeur de base de 215 nm, il faut ajouter 24 nm pour les groupes alkyles en a et b, soit un total de 239 nm en bon accord avec la valeur expérimentale.
L'exemple ci-dessous concerne la pulégone (du latin pulex : puce, en raison de la réputation de ce composé à éloigner ces insectes).
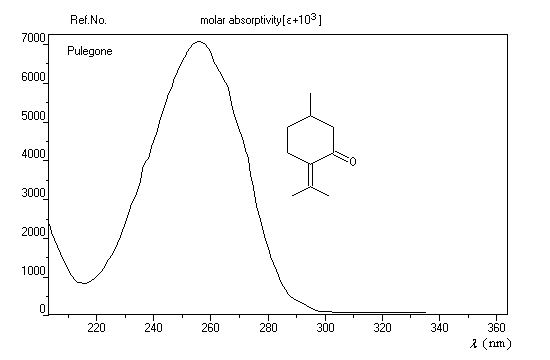
Associée aux études de spectres de dispersion rotatoire, l'analyse des spectres ultraviolets appuyée sur les règles de Woodward ont joué, par le passé, un rôle très important dans l'élucidation des structures de molécules complexes d'origine naturelle comme les stéroïdes. De nos jours, l'utilisation de la spectroscopie ultraviolette pour les recherches structurales a été supplantée par la spectroscopie RMN (1H et 13C).
Spectroscopie infrarouge
Les absorptions caractéristiques des aldéhydes et des cétones en spectroscopie infrarouge ont été étudiées dans le chapitre sur les composés carbonylés.
Stabilité
Du fait de leur caractère conjugué, les a-énones sont plus stables que les b-énones. Lorsque les conditions sont requises, celles-ci ont tendance à conduire aux premières par
isomérisation. La migration de la double liaison est catalysée par les acides. L'exemple suivant concerne l'isomérisation de la cholest-5-éne-3-one (I) en cholest-4-éne-3-one (II) plus stable.
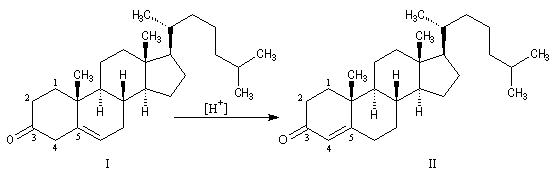
Ce type de réaction d'isomérisation explique pourquoi on doit utiliser un oxydant chimiosélectif comme le chlorochromate de pyridinium si l'on veut préparer la cholest-5-éne-3-one par oxydation du cholestérol.
Une autre solution consiste à bloquer la double liaison éthylénique sous forme de dérivé dibromé et de la régénérer
après oxydation.
Addition des organométalliques
La préparation des réactifs est décrite dans le chapitre sur les composés organométalliques. Les
principaux résultats sont donnés ci-dessous :
- les organolithiens fournissent préférentiellement le produit d'addition 1, 2. Le cation lithium, petit et peu polarisable est un acide dur, (h = 35,1 eV). Son association avec l'atome d'oxygène du groupe carbonyle qui est une base dure, (h = 19 eV), est à l'origine du phénomène d'activation électrophile. La réaction est sous contrôle de charge.
- les organomagnésiens fournissent généralement un mélange de produits d'addition 1, 2 et 1, 4 ;
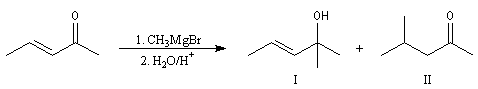
l'ajout de CuBr augmente considérablement l'addition 1, 4.
|
Composés |
I |
II |
|
sans CuBr |
90 |
10 |
|
avec CuBr |
5 |
95 |
- les cuprates lithiens de Gilman fournissent généralement de façon quasi exclusive le produit d'addition 1, 4.
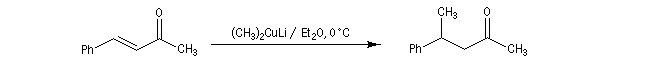
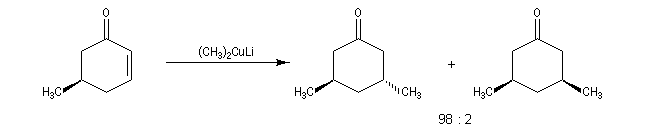
La réaction s'effectue avec une grande stéréosélectivité.
- Les réactifs de Knochel réagissent en position 4 sur les cétones a, b-insaturées en présence de chlorure de triméthylsilyle.
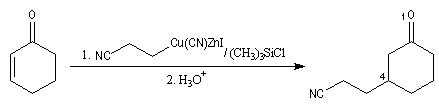
Plusieurs mécanismes ont été proposés pour expliquer la régiosélectivité de l'addition des cuprates sur les a-énones : mécanisme radicalaire, formation d'un complexe
p entre la double liaison éthylénique et l'organométallique (voir par exemple [18]). Des travaux récents sont en faveur de la formation d'un complexe p [55].
La molesse du carbone du carbone nucléophile du cuprate peut aussi être invoquée dans le cadre d'un contrôle orbitalaire de la réaction (Cu+ est un acide mou, de dureté de 6,9). L'attaque préférentielle
de l'organométallique a lieu sur l'atome de carbone qui possède le plus gros coefficient dans l'orbitale BV, donc sur l'atome C4.
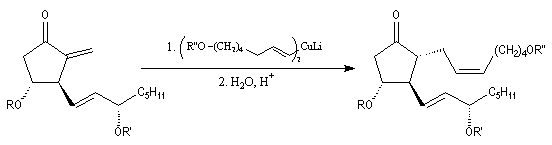
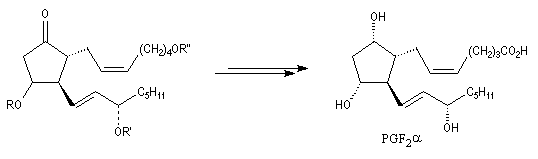
Synthèse de la prostaglandine PGF2a
La synthèse stéréosélective de la prostaglandine PGF2a selon la méthode mise au point par G. Stork, constitue un exemple de l'utilisation
des cuprates vinyliques en synthèse. Le cuprate s'additionne sur la face prochirale la moins encombrée de la double liaison éthylénique.
|
|
La prostaglandine PGF2a est une molécule biologique possédant des effets physiologiques importants. Elle intervient dans le cycle ovarien et dans le mécanisme provoquant l'accouchement. Elle a également une activité antiinflammatoire. La synthèse totale de cette
molécule a été réalisée par plusieurs équipes dont celle du chimiste américain E. J. Corey en 1970 [35] ainsi que par celle de son compatriote d'origine belge, G. Stork selon une voie différente dont quelques étapes sont décrites plus haut. Le précurseur biochimique des prostaglandines
est l'acide arachidonique.
|
Addition de Michaël
L'addition conjuguée d'un nucléophile sur un substrat a, b-éthylénique a été mise en évidence par le chimiste américain A. Michaël en 1887. Cette réaction, très précieuse
pour réaliser des allongements de chaînes carbonées, met en jeu des nucléophiles variés : ion énolate, ion cyanure, dithiane lithié, énamine, ylures de soufre, carbanions issus de dérivés nitrés etc. De même des substrats divers peuvent être utilisés comme accepteurs de Michaël : aldéhydes, cétones, esters, nitriles, nitroalcènes etc.
Leur point commun est de posséder une double liaison éthylénique rendue électrophile par la présence d'un
groupe attracteur conjugué avec elle.
Lorsque la réaction implique deux composés carbonylés, l'un jouant le rôle d'accepteur et l'autre de nucléophile, on obtient un système dicarbonylé 1,5. Dans le cas le plus simple cela donne le schéma de rétrosynthèse suivant :
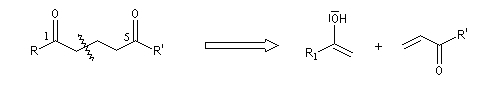
Avec une amine secondaire comme donneur, on aura :
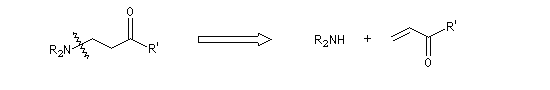
Des combinaisons variées, plus complexes, peuvent être utilisées mais le principe est toujours le même.
Examinons comme exemple le cas de l'addition d'un ion énolate sur un composé carbonylé. La préparation des énolates a été vue dans le chapitre relatif aux composés carbonylés.
- Une quantité catalytique de base suffit dans le cas où la formation de l'énolate
est réalisée sous contrôle thermodynamique.
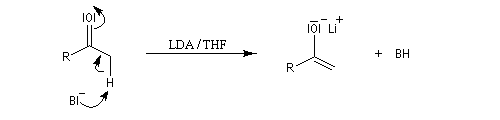
- La réaction peut être réalisée sous contrôle cinétique si l'énolate est préformé
par réaction entre le réactif de départ et un équivalent de base comme le LDA.
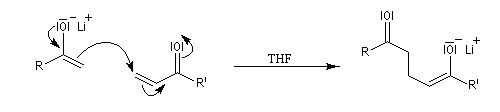
Nous allons nous placer dans ce cas pour voir le principe de la synthèse.
Cet énolate est mis à réagir avec l'accepteur de Michaël, ici une a-énone.
l'énol est obtenu en ajoutant un réactif protogène au milieu réactionnel ;
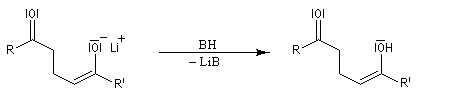
le produit final est le tautomère de l'énol précédent ;
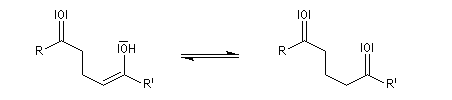
L'équilibre est en faveur du carbonylé du fait de la grande énergie de liaison du groupe carbonyle.
L'addition de Michaël peut être réalisée de façon intramoléculaire. La réaction ci-dessous est une étape de la synthèse du longifolène par Corey.
Addition de Michaël énantiosélective
L'exemple suivant concerne une synthèse de la (R)-(-)-muscone, une cétone à grand cycle de structure voisine de celle de la civétone par Tanaka et al [74]. excès énantiomérique est de 99 %.
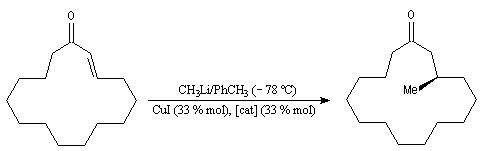
Des ligands chiraux dérivés de métallocènes sont aussi utilisés.
Annélation de Robinson
L'annélation de Robinson (en anglais : Robinson annulation) est la combinaison d'une réaction de Michaël suivie d'une condensation aldol. Cette synthèse de cycles a été mise au point par le chimiste britannique R. Robinson en 1935 [42]. Voici un exemple de cette réaction qui utilise l'énolate de la cyclohexanone. On commence par préparer cet ion énolate en déprotonant la cyclohexanone par le LDA.
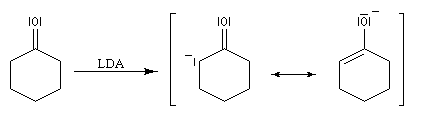
l'énolate obtenu est mis à réagir avec une a-énone, en l'occurence la méthylvinylcétone, qui joue le rôle d'accepteur de Michaël ;
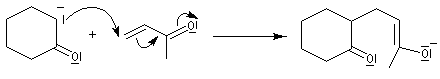
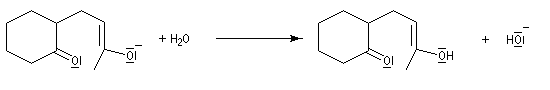
On obtient une dicétone 1,5.
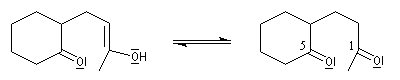
la dicétone obtenue subit une cyclisation par une réaction de cétolisation intramoléculaire ;
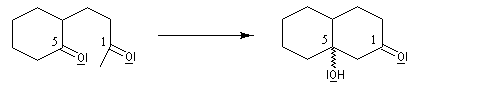
le cétol est ensuite facilement déshydraté pour conduire au produit final.
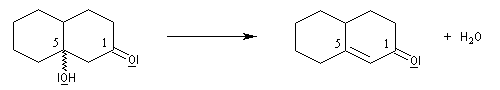
A la fin de ce processus, on obtient un nouveau composé carbonylé a, b-éthylénique.
Application 1 : synthèse de la cétone de Wieland-Miescher
|
|
La cétone de Wieland-Miescher sert de point de départ dans plusieurs synthèses de stéroïdes ou de terpènes comme celles du longifolène par E. J. Corey (1964), [72] et celle de J. E. Mc Murry et S. J. Isser (1972), [73].
|
L'exemple suivant concerne une application de la réaction d'annélation de Robinson à la préparation de la cétone de Wieland-Miescher [45],[79]. Cette cétone, qui porte le nom de ses deux découvreurs Karl Miescher et Peter Wieland de la firme pharmaceutique Ciba Geigy, sert de point de départ dans la synthèse de nombreux composés complexes. Elle comporte notamment les cycles A et B du squelette des stéroïdes.
Une synthèse énantiosélective utilisant la L-proline comme auxilliaire chiral a été mise au point. Il s'agit d'un cas particulier de la réaction de Hajos-Parrish au cours de laquelle le cétol n'est pas isolé du fait de la température de travail élevée. L'excès énantiomérique est voisin de 90 %.
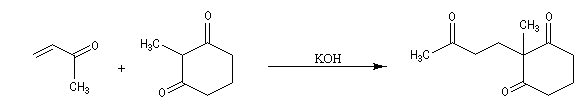
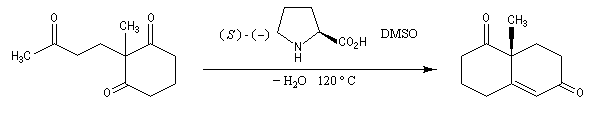
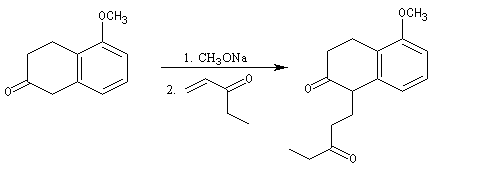
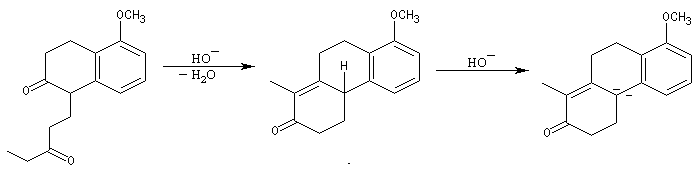
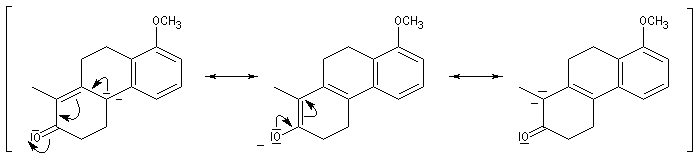
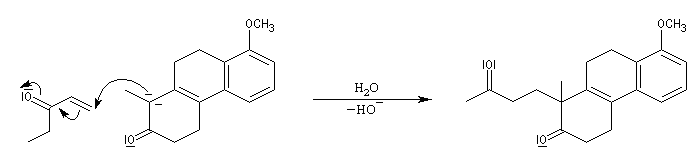
Application 2 : synthèse de stéroïdes
Le principe est le même que précédemment. Il y a cette fois quatre cycles à créer. On va donc utiliser deux fois successivement la suite de réactions : addition de Michaël suivie d'une cétolisation.
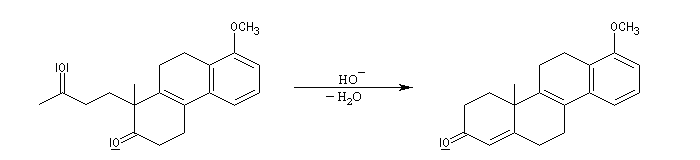
Réaction de Baylis-Hillman
L'origine de cette réaction remonte aux travaux du chimiste japonais K. Morita en 1968. L'auteur utilisait une phosphine substituée par des groupes cyclohexyle comme catalyseur. Le rendement, très faible, (< 20 %) de la réaction
limite les appplications possibles.
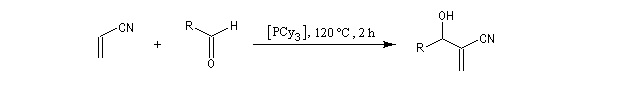
Un tournant décisif a été apporté par A. B. Baylis et M. E. Hillman en 1973. En utilisant une amine tertiaire encombrée comme catalyseur, le rendement est cette fois excellent [53].
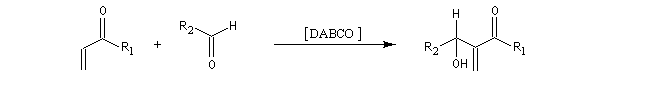
Le schéma général est le suivant :
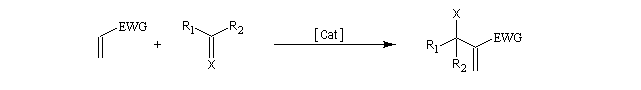
EWG : "electron withdrawing group" : désigne un groupe attracteur d'électrons.
Il s'agit donc d'une méthode très générale de synthèse de composés acryliques.
La première étape de la transformation est l'addition réversible d'une amine tertiaire comme DABCO, DBU ou encore la DMAP sur une a-énone, jouant le rôle d'accepteur de Michaël. Il y a formation d'un zwitterion.
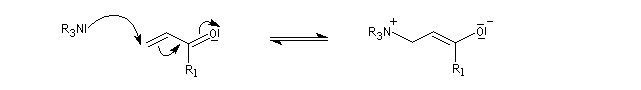
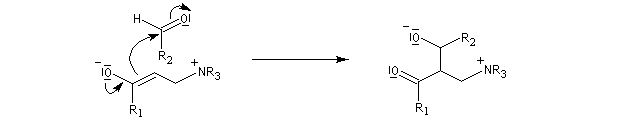
La deuxième étape est une condensation de type aldol entre le zwitterion se comportant comme un anion énolate et un aldéhyde. Cette étape est cinétiquement déterminante.
L'étape suivante est l'élimination du catalyseur (élimination de type Hofmann).
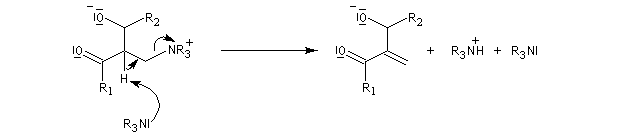
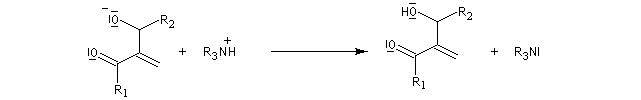
Puisque l'étape cinétiquement déterminante est la réaction entre le zwitterion et l'aldéhyde, on peut accélérer la réaction de deux façons :
- en stabilisant le zwitterion ;
- en utilisant un aldéhyde plus électrophile.
Notons que les cétones réagissent seulement à pression élevée.
Un des grands intérêts de la réaction de Baylis Hillman provient du fait qu'il en existe des versions stéréosélectives.
La version diastéréosélective suivante utilise comme auxilliaire chiral un sultame d'Oppolzer.
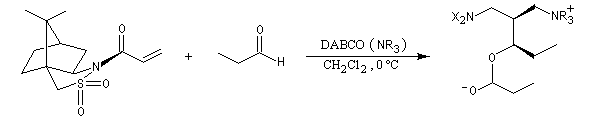
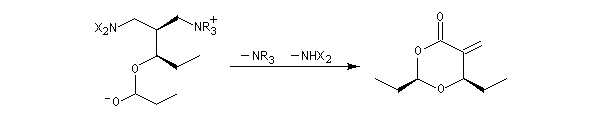
Il existe des versions énantiosélectives utilisant des catalyseurs chiraux [61].
Bibliographie
Ouvrages expérimentaux
[1] Manuel d'expériences de chimie - UNESCO Société chimique de France - Université de Montpellier.
[2] P. Rendle, M. V. Vokins, P. Davis, Experimental Chemistry (Edward Arnold).
[3] L. F. Fieser, K. L. Williamson - Organic Experiments (D. C. Heath and Company).
[4] R. Adams, J. R. Johnson, C. F. Wilcox - Laboratory Experiments in Organic Chemistry (The Macmillan Company, Collier-Macmillan Limited).
[5] G. K. Helmkamp, H. W. Johnson Jr, Selected Experiments in Organic Chemistry (W. H. Freeman and Co).
[6] Vogel's Textbook of Practical Organic Chemistry (Longman).
[7] J. R. Mohrig, D. C Neckers, Laboratory Experiments in Organic Chemistry (D. Van Nostrand Company).
[8] R. Q. Brewster, C. A. Van der Werf, W. E. Mc Ewen, Unitized Experiments in Organic Chemistry (D. Van Nostrand Company).
[9] F. G. Mann, B. C. Saunders, Practical Organic Chemistry (Longman).
[10] M. T. Yip, D. R. Dalton, Organic Chemistry in the Laboratory (D. Van Nostrand Company).
[11] Journal of Chemical Education.
[12] S. Hünig, E. Lücke, W. Brenninger, Organic Syntheses.
Ouvrages théoriques
[13] A. Streitwieser Jr, C. H. Heathcock - Introduction to Organic Chemistry, Macmillan Publishing Co.
[14] J. March - Advanced organic chemistry, Wiley Interscience.
[15] F. A. Carey, R. S. Sunberg - Advanced Organic Chemistry, Plenum Press 1990.
[16] V. Minkine - Théorie de la structure moléculaire, Editions Mir 1979.
[17] N. T. Ahn - Introduction à la chimie moléculaire, Ellipses 1994.
[18] R. Brückner - Mécanismes réactionnels en chimie organique, De Boeck Université 1999.
[19] R. B. Woodward, R. Hoffmann, The conservation of Orbital Symmetry (Verlag Chemie, Weinheim 1970.) Voir aussi : [31]
[20] P. Laszlo - Logique de la synthèse organique. Cours de l'Ecole Polytechnique, Ellipses, 1993.
[21] P. Atkins - Molecular Quantum Mechanics, Oxford University Press 1983.
[22] J. -L. Rivail - Eléments de chimie quantique à l'usage des chimistes, InterEditions du CNRS, 1989.
[23] P. -G. de Gennes et J. Badoz - Les objets fragiles, Plon 1994.
[24] I. Fleming, Frontier Orbitals and Organic Chemical Reactions, Wiley 1976.
[25] P. Chaquin, F. Volatron, Chimie organique : une approche orbitalaire de Boeck 2015
Liens
[30] Organic Pericyclic reaction by H. Rzepa at the Department of Chemistry Imperial College.
[31] The Conservation of Orbital Symmetry by R.B. Woodward and R. Hoffmann
(article historique dans lequel ont été exposées pour la première fois les règles de Woodward-Hoffmann.)
[32] The conservation of Orbital Symmetry by Rob Knowles.
(article dans lequel sont expliquées de façon concise et élégante les règles de Wodward-Hoffmann et la méthode des orbitales frontières de Fukui ; MacMillan Group Meeting
February 2nd, 2007.
Voir aussi les cours de P. Chaquin [36] et P. Le Floch [56])
[33] The synthesis and reactivity of Cubane by Beinn Muir
[34] Diels-Alder reaction Organic chemistry portal
[35] Total Synthesis of prostaglandin PGF2a by E. J. Corey and Co-workers The Organic Synthesis Archive
[36] Orbitales frontières, cycloadditions Cours de P. Chaquin
[37] O. Diels and K. Alder the Nobel Prize in Chemistry 1950
[38] K. Fukui and R. Hoffmann the Nobel Prize in Chemistry 1981
[39]
[40] Michaël addition Organic chemistry portal
[42] Robinson annulation Organic chemistry portal
[43] Diels-Alder reaction an animation
[44] K. Ziegler and G. Natta the Nobel Prize in Chemistry 1963
[45] Wieland Miescher Ketone by Paul Buchschacher, A. Fürst, and J. Gutzwiller
[46] The Diels-Alder Reaction in Total Synthesis by K. C. Nicolaou
[50] Conducting Polymers Imperial College
[51] The Nobel Prize in Chemistry 2000
[52] Etude de polymères conducteurs Thèse de Cristele Vanga Bouanga
[53] The Morita-Baylis-Hillman reaction by Stephen Goble.
[54] The Woodward Hoffmann rules and the conservation of Orbital Symmetry by Scott Virgil
[55] The Gamma Irones by John C. Leffingwell
[56] Introduction à la chimie moléculaire par les orbitales frontières Pascal le Floch, Ecole Poytechnique
[57] Patchoulol
[58] Molecule of the month : Taxol by Neil Edwards.
[59] Taxol Synthesis by R. Holton
[60] Russell Marker and the Mexican Steroid Hormone Industry ACS
[61] Asymmetric Morita-Baylis-Hillman Reactions Catalyzed by Chiral Brønsted Acids by Nolan T. McDougal and Scott E. Schaus
Articles
[70] Aromaticity, Special Publication N° 21, The Chemical Society, London (1967).
[71] R. B. Woodward, R. Hoffmann ; J. Am. Chem. Soc., 87, 395 (1965).
[72] Corey, E. J. ; Mitra, R. B. ; Vatakencherry, P. A. ; J. Am. Chem. Soc. 86, 478 (1964).
[73] McMurry, Isser S. J. ; J. Am. Chem. Soc., 94, 7132 (1972).
[74] K. Tanaka, J. Matsui, H. Suzuki, J. Chem. Soc., Perkin Trans. 1, 1993, 15.
[75] Fukui K., Yonezawa T., Shingu H., J. Chem. Phys., 1952, 20, 722 (article original de Fukui concernant la théorie des orbitales frontières.)
[76] J. Rakowitz, Excitant oxygène singulet, Bulletin de l'Union des Physiciens, novembre 1984.
[77] Steven H. Bertz, Anu Chopra, Magnus Eriksson, Craig A. Ogle, and Paul Seagle. J. Am. Chem. Soc., 124 (46), 13650 - 13651, 2002. 10.1021.
[78] W. S. Rapson, R. Robinson, J. Chem. Soc. 1935, 1285
[79] Wieland, P.; Miescher, K. Helv. Chim. Acta 1950, 33, 2215–2228.
[80] Nicolaou, KC ; Yang, Z ; Liu, JJ ; Ueno, H; Nantermet, PG ; Guy, RK ; Claiborne, CF; Renaud, J et al. (February 1994) Nature 367 (6464): 630–634.
RETOUR AU MENU DU COURS
Vous pouvez, si vous le souhaitez, utiliser le contenu de cette page dans un but pédagogique et non commercial.
Texte, dessins, photographies : Gérard Dupuis - Lycée Faidherbe de LILLE
novembre 2016