Cours de chimie Organique - G. Dupuis - Lycée Faidherbe Lille
Ethers acycliques, éthers d'énols, époxydes
Ethers non cycliques
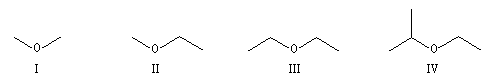
On appelle éther un composé dans lequel un atome d'oxygène est lié par liaison simples à deux groupes organiques différents. La nomenclature recommandée par l'UICPA est la nomenclature substitutive. Les éthers simples sont nommés comme des alkoxyalcanes. La nomenclature radico-fonctionnelle est encore largement utilisée surtout pour les éthers les plus simples. A ces noms systématiques, il convient d'ajouter les noms usuels. Ainsi l'éthoxyéthane est appelé couramment éther ordinaire ou éther sulfurique par référence à son mode d'obtention.

|
I |
II |
III |
IV |
|
méthoxyméthane |
méthoxyéthane |
éthoxyéthane |
2-éthoxypropane |
|
oxyde de diméthyle |
oxyde de méthyle et d'éthyle |
oxyde de diéthyle |
oxyde d'éthyle et de 2-méthyléthyle |
Ethers cycliques
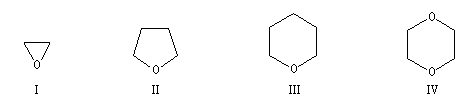
Le nom de base est celui du cyclane. Les atomes d'oxygène qui remplacent ceux de carbone dans le cycle sont indiqués par oxa.
|
I |
II |
III |
IV |
|
oxacyclopropane |
oxacyclopentane |
oxacyclohexane |
1,4-dioxacyclohexane |
|
oxyde d'éthène |
tétrahydrofurane (THF) |
tétrahydropyrane (THP) |
dioxane |
Les éthers possédant trois chaînons sont nommés oxacyclopropanes. Ils sont aussi appelés plus couramment époxydes. Leur réactivité est beaucoup plus grande que celle des autres éthers et on leur consacrera un paragraphe spécial.
Caractéristiques géométriques et énergétiques
L'atome d'oxygène des éthers contracte deux liaisons simples avec les atomes de carbone des groupes organiques liés. Il reste donc deux paires d'électrons non liantes sur l'atome d'oxygène. La géométrie localement plane autour de l'atome d'oxygène dérive d'un arrangement tétraédrique des paires d'électrons. Puisque les paires non liantes occupent en moyenne un volume plus grand que les paires liantes, on prévoit un angle entre les liaisons supérieur à celui observé dans un tétraèdre régulier c'est à dire a >109°.
Le tableau suivant regroupe quelques valeurs moyennes de grandeurs géométriques et énergétiques. Remarquons la valeur élevée de l'énergie de dissociation de la liaison C-O.
|
d (C-O) (nm) |
a (COC) (°) |
Do (C-O) (kJ.mol-1) |
|
0,141 |
118 |
343 |
La présence de l'atome d'oxygène plus électronégatif (3,5 dans l'échelle de Pauling) que les atomes de carbone (2,5) et d'hydrogène (2,1) ainsi que la géométrie de la molécule sont à l'origine d'un moment dipolaire permanent pour la molécule de la plupart des éthers.
|
composé |
constante diélectrique er |
moment dipolaire m (D) |
|
éthoxyéthane |
4,2 |
1,25 |
|
tétrahydrofurane |
7,4 |
1,70 |
Certains éthers comme le dioxane ne possèdent pas de moment dipolaire permanent car les moments dipolaires de liaison se compensent. L'absence de liaison H entraîne des températures de changement d'état plus faibles que celles des alcools de même masse molaire.
|
nom |
TF (°C) |
TE (°C) |
|
méthoxyméthane |
-138,5 |
-23 |
|
éthoxyéthane |
-116,62 |
34,5 |
Les composés cycliques ont des points d'ébullition plus élevés que les non cycliques. En effet, leur structure plus compacte permet des interactions de Van der Waals plus importantes entre les molécules.
Spectroscopie infrarouge
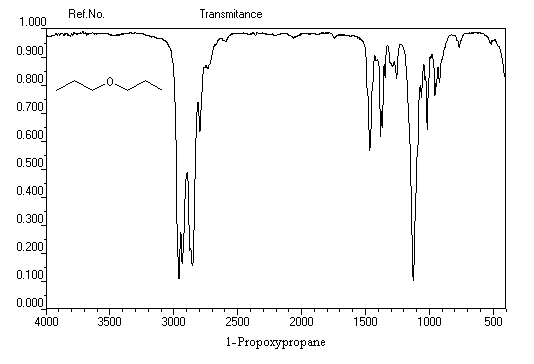
On distingue les éthers non cycliques, les éthers cycliques et dans cette famille les époxydes. Les valeurs suivantes correspondent aux éthers non cycliques.
|
vibration |
C-O-C (asym) |
C-O-C (sym) |
|
nombre d'onde (cm-1) |
1260-1070 (forte) |
1055-870 (forte) |
Le spectre infrarouge ci-dessous est celui du propyloxypropane ou oxyde de dipropyle.
|
L'éthoxyéthane est l'éther le plus utilisé comme solvant. Il est peu toxique (VME 1200 mg.m-3 ). Il est très volatil (TE = 34,6 °C) et extrêmement inflammable comme en témoigne un point éclair très bas (TE = -40°C). Il a été utilisé comme anesthésique. On peut l'obtenir par déshydratation intermoléculaire de l'éthanol en présence d'acide sulfurique à 130-140 °C.
|
|
Le 2-méthoxy-2-méthylpropane ou méthyltertiobutyléther (MTBE) améliore l'indice d'octane des supercarburants qui peuvent en contenir jusqu'à 13,6 % en masse. On l'obtient par réaction entre le méthylpropène et le méthanol, catalysée par une résine acide (polystyrène sulfonique réticulé).
|
|
Le tétrahydrofurane est un éther très utilisé comme solvant en synthèse. Il a une température d'ébullition plus grande que l'éthoxyéthane (TE = 67 °C). Il est narcotique et toxique (VME 590 mg.m-3). On peut l'obtenir par déshydratation du butan-1,4-diol. Il est difficile de le conserver sec car il est assez miscible avec l'eau.
|
Dioxane
|
Le dioxane est utilisé comme solvant. Il possède une température d'ébullition assez élevée (TF = 11 °C, TE = 101,3 °C). C'est un composé toxique. On peut l'obtenir par déshydratation intermoléculaire de l'éthylèneglycol sous l'action de l'acide sulfurique.
|
|
On prépare ce composé par réaction entre l'éthène et le dioxygène à 170 °C en présence d'Ag comme catalyseur. A la température ordinaire c'est un liquide toxique (TE = 12,5 °C).
Il est utilisé comme intermédiaire en synthèse organique. |
Utilisation des éthers en tant que solvants au laboratoire
Séchage des éthers
Les éthers peuvent contracter des liaisons H avec l'eau ou les alcools avec lesquels ils sont miscibles dans une certaine proportion. L'utilisation de réactifs incompatibles avec l'eau même à l'état de traces comme les organométalliques pose le problème du séchage des éthers.
A la température ordinaire, le méthoxyméthane est miscible à l'eau en toutes proportions. L'éthoxyéthane, qui possède une chaîne carbonée plus longue, l'est nettement moins. Cependant il peut contenir jusqu'à 1,5 % d'eau.
Le THF est beaucoup plus miscible à l'eau que l'éther ordinaire. On l'attribue au fait que les doublets non liants de l'oxygène sont beaucoup plus accessibles pour contracter des liaisons H. Son séchage revêt une importance particulière en synthèse organique.
On distingue plusieurs étapes selon la quantité d'eau présente dans l'éther :
|
|
Les zéolithes naturelles ont été découvertes par le minéralogiste A. F. Cronsted en 1756 qui leur a donné leur nom (pierre qui bouillent) car elles bouillonnent quand on les chauffe. Ces aluminosilicates possèdent une structure caractérisée par la présence de cages reliées entre-elles par des tunnels. On sait produire artificiellement des zéolithes possédant des cages de tailles calibrées. Elles peuvent servir à séparer les constituants d'un mélange par piégeage de molécules comme l'eau dans les cavités, d'où leur nom de tamis moléculaire. La photographie de gauche représente des tamis moléculaires dont les cavités font 0,4 nm (tamis 4 A) en extrudés de 1,6 mm. Ils sont utilisés pour le séchage des liquides organiques. On peut conserver les éthers sur ce type de tamis placé au fond de la bouteille. |
|
|
Dans le ballon, surmonté d'un réfrigérant ascendant, on a placé du THF préalablement séché sur tamis moléculaire, des petits morceaux de sodium (coupés en dés de 5 mm environ) et une spatule de benzophénone. Le mélange est agité plusieurs dizaines de minutes sous la hotte.
|
En présence d'eau, même en très faible quantité, le radical-anion réagit immédiatement pour donner le diphénylméthanol et on n'observe pas de coloration bleue. Cette réaction peut donc constituer un test de la présence d'eau dans le THF lors de son séchage sur sodium. L'élimination complète de l'eau peut exiger plusieurs dizaines de minutes selon la quantité présente au départ.
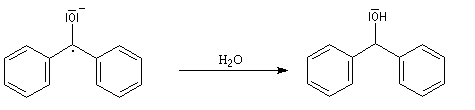
Cette manière de procéder combine l'avantage d'un séchage total et de l'élimination des peroxydes car ces derniers sont réduits par le sodium.
Remarque : la réduction des cétones en alcool par le sodium est une réaction connue depuis longtemps (réaction de type Bouvault et Blanc). Elle a toujours de l'intérêt car elle possède une assez grande stéréosélectivité. Il existe d'autres réactions de réduction passant par des anions- radicaux intermédiaires. C'est le cas, par exemple, de la réduction de Birch des aromatiques.
Extraction par solvant
L'éthoxyéthane est souvent utilisé comme solvant d'extraction car il dissout de nombreuses matières organiques et il est facile à éliminer. Un appareil simple utilisé pour les extractions liquide-liquide est l'ampoule à décanter.
|
|
L'ampoule à décanter (qu'il ne faut pas confondre avec une ampoule de coulée) est utilisée pour l'extraction liquide-liquide. La solution S contenant le composé à extraire et le solvant d'extraction S (par exemple l'éther) sont introduits dans l'ampoule. Le composé à extraire A se partage entre les deux solvants selon un équilibre qu'on peut schématiser par l'équation :A(S) = A( S )Le rapport : K = [A( S )]/[A(S)]s'appelle coefficient de partage. A une température donnée, c'est une constante. L'extraction est d'autant plus complète que K est plus grand. Pour extraire la quantité maximale de composé d'une solution on a intérêt à procéder en plusieurs étapes. On réalise des extractions successives avec plusieurs fractions de solvant. Les phases organiques sont ensuite combinées. |
Le b-carotène, est un hydrocarbure possédant 11 doubles liaisons conjuguées ce qui explique sa couleur orange. Du fait de sa longue chaîne carbonée hydrophobe, il est beaucoup plus soluble dans l'éther que dans l'eau. On peut l'extraire d'une solution aqueuse en utilisant ce solvant.
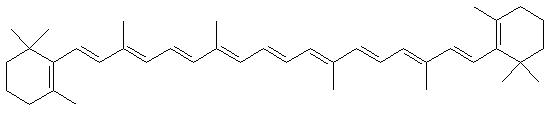
Les photographies ci-dessous représentent l'extraction du b-carotène d'une solution aqueuse par l'éthoxyéthane.
|
|
|
Photographie I : le mélange de la solution aqueuse de b -carotène et d'éther est agité vigoureusement. L'opérateur ouvre le robinet après chaque agitation pour équilibrer la pression interne et la pression atmosphérique. C'est l'opération d'extraction proprement dite.
Photographie II : la phase organique constituée de b -carotène dans l'éther constitue la phase supérieure. La phase aqueuse qui ne contient presque plus de carotène constitue la phase inférieure. Ces phases se sont distribuées dans cet ordre par décantation. Elles peuvent ensuite être séparées avec précision grâce à la forme particulière de la partie terminale de l'ampoule. |
|
I |
II |
Remarque : il n'est pas toujours évident d'identifier la phase aqueuse et la phase organique si celles-ci sont incolores. Un moyen simple pour repérer la phase aqueuse consiste à ajouter une goutte d'eau dans l'ampoule et à regarder la phase qu'elle rejoint.
Elimination du solvant
Un des avantages de l'éther comme solvant d'extraction est qu'il peut être éliminé rapidement du fait de sa grande volatilité.
|
|
Un appareil couramment utilisé pour éliminer l'éther (ou plus généralement le solvant) d'un mélange, est l'évaporateur rotatif (appelé souvent "rotavapor"). Le mélange de solvant et de soluté est placé dans le ballon de droite. Celui-ci est plongé dans un bain-marie. Il est incliné et animé d'un mouvement de rotation de manière à créer un film de liquide et ainsi accroître la surface d'évaporation du solvant. La pression à l'intérieur du montage est abaissée au moyen d'une trompe à eau ce qui augmente la vitesse d'évaporation. Après condensation dans le réfrigérant, le solvant est récupéré dans le ballon de gauche. |
Un schéma de ce type d'appareil est représenté ci-dessous.
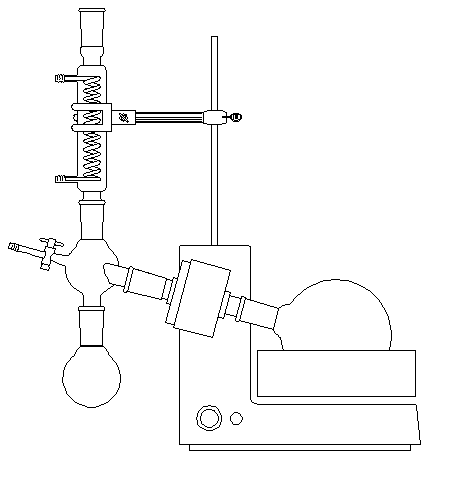
Avant de procéder à l'élimination du solvant il est impératif de vérifier que l'éther est exempt de peroxydes. Ces opérations doivent être réalisées en l'absence de toute flamme et de toute étincelle en raison de la grande inflammabilité de l'éther.
Basicité de Lewis
L'existence de doublets non liants sur l'atome d'oxygène entraîne une réactivité de base de Lewis.
|
Avec l'acide de Lewis BF3 on obtient un complexe stable : l'éthérate de trifluorure-bore.
|
Avec les époxydes, la réaction avec BF3 peut conduire à la formation de composés carbonylés.
Ce caractère basique se manifeste vis à vis des organométalliques comme les magnésiens aussi bien à l'état solide qu'en solution. Dans ce cas plusieurs équilibres tels que l'équilibre de Schlenk peuvent intervenir simultanément.
Les éthers tels que Et2O manifestent des propriétés complexantes vis à vis de composés des éléments de transition.
|
|
En ajoutant quelques gouttes d'une solution aqueuse de peroxyde d'hydrogène H2O2 (1 M) à une solution de dichromate de potassium K2Cr2O7 (1 M) acidifiée par H2SO4, on obtient de façon fugace une coloration bleue. En ajoutant de l'éthoxyéthane au mélange la coloration se stabilise. Après décantation, la phase éthérée est bleue. Elle contient un composé peroxo du chrome complexé par l'éther : [CrO(O2)2Et2O].
Remarque : les composés du Cr (VI) sont dangereux (caractère cancérigène). Porter des gants pour manipuler ces composés et travailler sous une hotte ventilée. |
Basicité de Brönsted
Les éthers sont aussi des bases de Brönsted très faibles. Leurs acides conjugués constituent des sels d'oxonium qui sont des acides forts : pKa (R2OH+/R2O) # -3,5.
Le chlorure d'hydrogène est ionisé dans l'éthoxyéthane. Mais, à la différence de ce qui se passe dans l'eau, les solutions obtenues ne sont pas conductrices du courant électrique car l'éther, qui possède une constante diélectrique assez faible, (er = 4,3) si on la compare à celle de l'eau, (er = 78,5) ne permet pas la dissociation des paires d'ions.
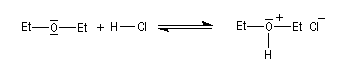
La protonation des éthers joue un rôle important dans la réaction de coupure par les acides possédant un anion nucléophile car elle augmente le caractère nucléofuge de l'oxygène et facilite la rupture de la liaison C-O.
Action des acides
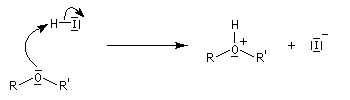
Les éthers, autres que les époxydes, sont stables en milieu basique sauf en présence de bases très fortes comme les organolithiens. En revanche, la liaison C-O peut être rompue en milieu acide, notamment par les acides halohydriques. Un réactif utile pour couper les éthers est HI qui les clive dès la température ambiante (réaction de Zeisel). Son rôle est double : H+ protone l'oxygène ce qui améliore considérablement son aptitude nucléofuge et I-, qui est un bon nucléophile, induit la coupure de la liaison C-O en réalisant une substitution nucléophile.
HBr coupe les éthers vers 100 °C et HCl à une température encore plus élevée car les anions sont de moins en moins nucléophiles.
Lorsque l'atome de carbone impliqué dans la fonction éther est plus substitué, on peut observer des substitutions de type SN1 qui s'accompagnent alors d'un certain pourcentage d'élimination.
|
L'oxyde de ditertiobutyle est instable en milieu acide à cause de la répulsion des groupes méthyle (examiner le modèle "spacefill"). Comme la réaction passe par l'intermédiaire d'un carbocation, on obtient aussi une proportion non négligeable de méthylpropène par élimination.
|
Utilisation des éthers comme groupes protecteurs
Du fait de leur faible réactivité, les éthers sont largement utilisés comme groupement protecteur des fonctions alcool et phénol. L'éther est formé à partir de l' alcoolate ou du phénolate au moyen de la réaction de Williamson. Comme il a été dit plus haut, la déprotection peut être réalisée en présence d'acide iodhydrique. Il s'agit d'une méthode assez ancienne. Comme on le verra plus bas il existe des réactifs autorisant des conditions beaucoup plus douces.
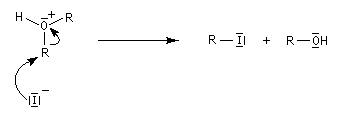
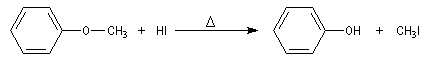
Notons que dans cette réaction on n'obtient pas PhI et CH3OH. On sait en effet que les réactions de substitutions nucléophiles en série aromatique obéissent à des mécanismes d'addition-élimination ou d'élimination-addition.
L'iodure de triméthylsilyle est un réactif très utile permettant la coupure des éthers dans des conditions douces.
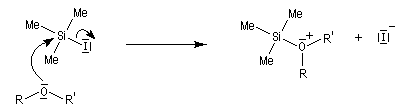
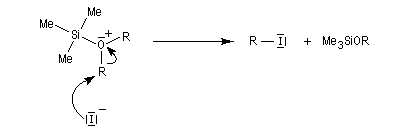
Il ne reste plus qu'à effectuer l'hydrolyse des produits formés pour récupérer deux alcools.
Les éthers de benzyle sont clivés sélectivement dans des conditions douces par H2 en présence de Pd/C.
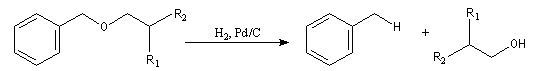
Pour cette raison, ils sont souvent utilisés comme groupement protecteur des alcools lorsque la déprotection ne peut être effectuée en milieu acide.
L'utilisation des éthers silylés en tant que groupes protecteurs fait l'objet d'un paragraphe particulier.
Réactions au voisinage de la fonction éther
Autoxydation
On sait depuis longtemps que les éthers laissés au contact de l'air en présence de lumière peuvent conduire à des mélanges dangereusement explosifs.
La réaction entre l'éther et le dioxygène s'appelle autoxydation. Elle conduit à la formation d'hydroperoxydes selon un mécanisme radicalaire en chaîne initié notamment par la lumière. Les hydroperoxydes sont thermodynamiquement instables du fait de la faible énergie de la liaison O-O (140 kJ.mol-1. Ils évoluent au cours du temps pour donner des peroxydes (ou des polymères de peroxydes) qui peuvent exploser violemment sous l'action d'une élévation de température, ou d'un choc.
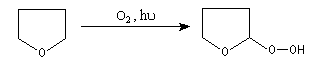
Avant de distiller un éther il est impératif de vérifier l'absence d'hydroperoxyde. Ces composés sont moins volatils que l'éther du fait d'une masse molaire plus grande et ils ont tendance à se concentrer dans le ballon au cours de la distillation. Lorsque leur concentration a atteint une valeur critique, ils peuvent être à l'origine d'explosions très violentes.
|
|
Un test simple consiste à faire réagir la solution dans laquelle on soupçonne la présence d'hydroperoxyde avec une solution de KI (mélanger 0,5 mL d'éther, 1 mL de KI à 10 % et 0,5 mL d'acide éthanoïque. Agiter. En présence de peroxydes la solution devient brune car I-est oxydé en I2 qui forme avec I- l'ion I3- (image de gauche). L'expérience a été réalisée du THF provenant d'une bouteille entamée depuis quelques mois.
Un autre test très sensible, consiste à utiliser une solution de thiocyanate de Fe (II). Par oxydation il se forme le complexe [Fe(SCN)]2+ de couleur rouge. |
On peut éliminer les hydroperoxydes d'une solution d'éther en les réduisant par une solution acidifiée d'ions Fe2+. Dans cette réaction, Fe2+ est oxydé en Fe3+.
Le mécanisme est du type radicalaire en chaîne.
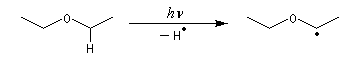
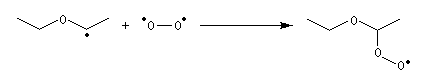
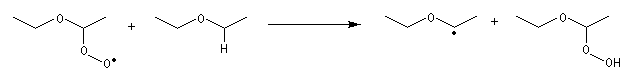
Les éthers commerciaux, notamment le THF, sont stabilisés par des antioxygènes comme le 2,6-ditertiobutylparacrésol. Les phénols qui sont très sensibles à l'oxydation par O2 jouent le rôle de pièges à radicaux dans la réaction en chaîne d'oxydation. Le MTBE présente l'avantage par rapport aux autres éthers d'être très peu sensible à la peroxydation. Notons que les éthers ayant tendance à former des peroxydes, il ne faut pas les utiliser comme solvant dans les réactions impliquant des radicaux en présence d'oxygène.
On conserve les éthers sur tamis moléculaire en présence d'une atmosphère inerte et à l'abri de la lumière.
De nombreux composés organiques sont sensibles à la peroxydation. Par exemple les acides gras. Voir : [19].
Certains hydroperoxydes sont utilisés en synthèse organique. L'hydroperoxyde de tert-butyle (TBHP) intervient notamment dans l'époxydation de Sharpless.
Halogénation
La réaction avec Cl2 de type radicalaire, permet de substituer l'atome d'hydrogène porté par le C en a de l'atome d'oxygène par un atome de chlore.
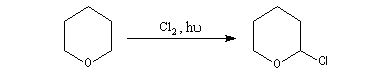
Les a-halogénoéthers sont des composés intéressants car l'atome de chlore est rendu mobile par sa proximité avec l'atome d'oxygène. Il peut être substitué par une assez grande variété de nucléophiles. La préparation du 2-hydroxypyrane qui intervient dans la synthèse du dihydropyrane (DHP) illustre cette propriété.
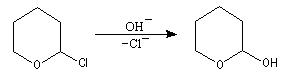
Le 2-hydroxypyrane conduit au DHP par élimination d'eau en milieu acide.
Elimination
Sous l'action de bases très fortes comme les organosodiques ou les organolithiens et dans une moindre mesure les organomagnésiens, l'atome d'hydrogène porté par le carbone en b de l'oxygène peut être arraché. Une réaction d'élimination conduit à un alcène et à un alcoolate.
![]()
C'est la raison pour laquelle il est préférable d'effectuer le dosage des lithiens comme le butyllithium quand ils sont restés longtemps dans leur solvant. Les organosodiques sont si réactifs vis à vis des éthers qu'on ne les prépare pas dans ce solvant mais dans des hydrocarbures.
Transposition de Claisen
Lorsqu'on chauffe à 200 °C le prop-2-ényloxybenzène (oxyde d'allyle et de phényle), on obtient le 2-(prop-2-ényl)-phénol (orthoallylphénol). La réaction constitue un exemple d'une réaction très générale qui affecte les éthers de vinyle et d'allyle : la transposition de Claisen mise en évidence par Ludwig Claisen (1851-1930).
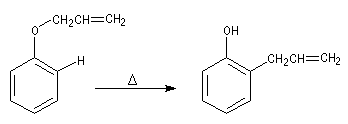
Il s'agit d'un exemple de transposition sigmatropique [3, 3'] tout comme pour la transposition de Cope des diènes-1, 5. Le mécanisme fait intervenir un état de transition cyclique. La force motrice d'une transposition de Claisen ordinaire est la formation d'un groupe carbonyle qui possède une grande énergie de liaison. Ici, la diénone n'est qu'un intermédiaire qui se tautomérise en phénol beaucoup plus stable du fait de son caractère aromatique.
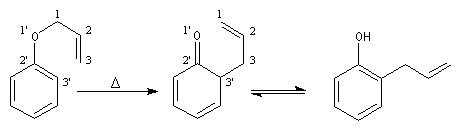
Il existe plusieurs voies d'accès aux époxydes. En voici quelques-unes parmi les plus importantes.
A partir des composés carbonylés. Le réactif est un ylure de soufre. Cette réaction dite de Corey-Chaykovsky a acquis une grande importance en synthèse organique du fait de sa stéréosélectivité. Elle est examinée dans la partie consacrée aux composés carbonylés.
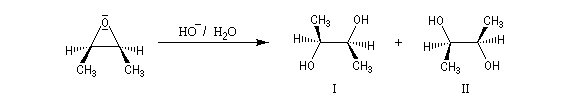
Ouverture nucléophile par les ions hydroxyde
Le traitement par l'eau du plus simple des époxydes, l'oxacyclopropane, conduit à la formation d'éthanediol.
![]()
La réaction entre les ions hydroxyde et le (2R,3S)-diméthyloxacyclopropane méso fournit un mélange racémique du (2S,3S)-butane-2,3-diol (composé I) et du (2R,3R)-butane-2,3-diol (composé II) énantiomères (couple like).
Le mécanisme correspond à une réaction bimoléculaire SN2 entre le substrat et le nucléophile.
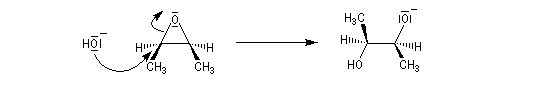
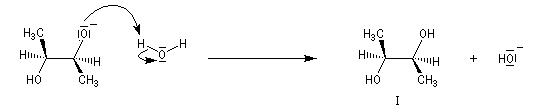
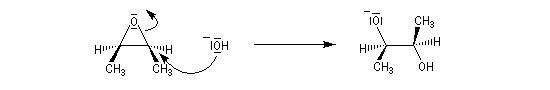
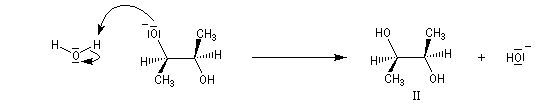
Plus généralement, à partir des deux époxydes énantiomères, on obtient seulement deux composés différents énantiomères .
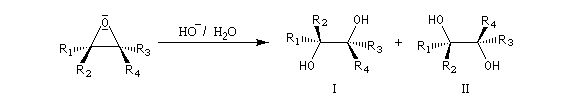
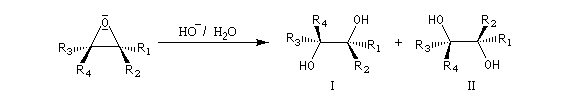
Deux époxydes diastéréo-isomères fourniront, dans les mêmes conditions des diols diastéréo-isomères. La réaction d'ouverture est donc diastéréospécifique.
Puisque les époxydes sont facilement obtenus par réaction entre un peroxyacide et un alcène, cette suite de réactions constitue une dihydroxylation de ceux-ci permettant la synthèse de diols. Si l'on se réfère à la stéréochimie de l'alcène de départ, l'ensemble des deux réactions époxydation suivie de l'ouverture de l'époxyde est globalement diastéréospécifique de stéréochimie anti.
La dihydroxylation diastéréospécifique syn des alcènes est réalisable au moyen du permanganate de potassium ou du tétroxyde d'osmium.
Lorsque le cas se présente, l'ouverture nucléophile est régiosélective. Le nucléophile attaque l'époxyde sur l'atome de carbone le plus dégagé donc le moins substitué.
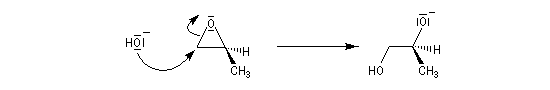
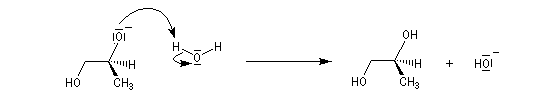
Si les substituants sont différents, au niveau du site réactionnel, on observe une inversion de configuration de l'atome de carbone correspondant ce qui indique que la réaction est du type SN2.
Ouverture nucléophile avec les organométalliques
La réaction entre un époxyde comme l'oxacyclopropane et un organomagnésien ou un organolithien constitue une synthèse d'alcool avec allongement de chaîne carbonée.
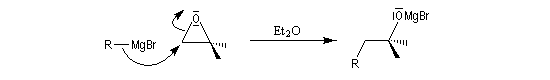
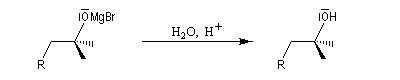
L'organomagnésien réagit du côté opposé au pont et la réaction procède d'un mécanisme de type SN
2. Lorsque l'époxyde est dissymétrique la réaction préférentielle implique l'atome de carbone qui est stériquement le plus dégagé. Conformément au mécanisme précédent, la réaction s'accompagne en général d'une inversion de configuration de cet atome.Autres ouvertures nucléophiles
Les réactions suivantes sont utiles en synthèse :
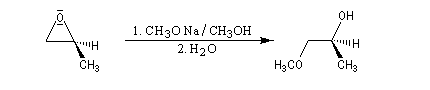
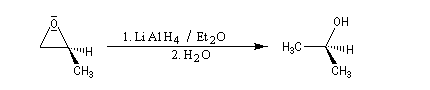
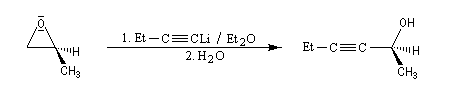
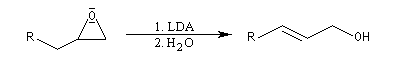
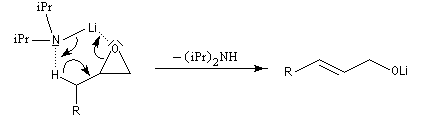
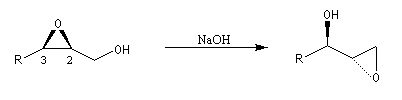
En milieu basique, la base arrache un proton à l'alcool pour former un ion alcoolate.
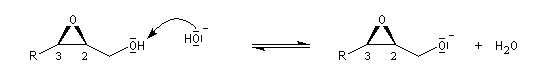
L'alcoolate réagit sur le carbone 2 de l'époxyde avec inversion de configuration de cet atome (réaction de type SN2).
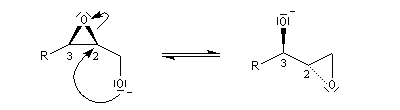
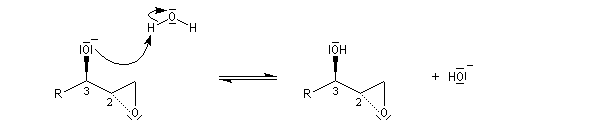
L'époxyde peut être ouvert in situ par un nucléophile présent dans le milieu.
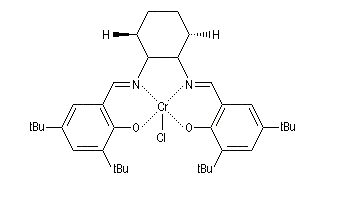
Ouverture énantiosélective Ils permettent l'ouverture énantiosélective d'époxydes méso sous l'action de différents réactifs, notamment des azides. Comme les azides sont facilement réduits en amines par des réducteurs comme LiAlH4, on obtient ainsi des aminoalcools chiraux. Dans la réaction ci-dessous [R, R-cat] désigne le catalyseur de Jacobsen précédent. L'énantiosélectivité est supérieure à 98 %. Cette méthode a été appliquée avec succès à la synthèse de synthons chiraux utilisés dans la synthèse d'un inhibiteur de la protéine kinase C : le balanol. Ce composé possède des propriétés antivirales et antitumorales et pourrait être utilisé à des fins thérapeutiques. L'ouverture des époxydes méso peut être réalisée par déprotonation énantiosélective à l'aide d'une base chirale. Ce qui conduit à des alcools allyliques chiraux.
Certains complexes métalliques utilisant un ligand chiral dérivant du ligand salen ont été préparés assez récemment par E. Jacobsen (Harvard).
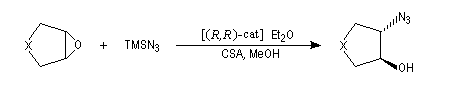
|
Un époxysilane peut être préparé par réaction entre un vinylsilane et un agent d'époxydation comme le m-CPBA.
|
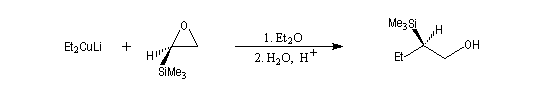
Ouverture des époxydes en milieu acide
La réaction est régiosélective. L'attaque du nucléophile s'effectue sur l'atome de carbone qui stabilise le mieux une charge positive c'est à dire sur l'atome de carbone substitué par le plus grand nombre de groupes alkyles. On a donc une régiosélectivité inverse de ce qu'on observe en milieu basique.
Avec un atome de carbone secondaire, la réaction reste bimoléculaire et stéréosélective anti.
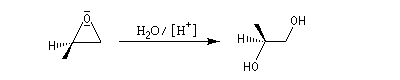
Lorsque l'atome de carbone impliqué est tertiaire, il se forme un véritable carbocation. La stéréosélectivité est perdue. Le mécanisme est alors de type SN1.
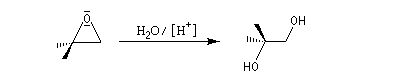
Ouverture électrophile : synthèse de composés carbonylés
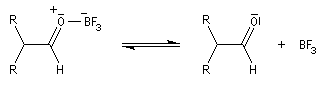
Les époxydes réagissent avec le trifluorure de bore BF3 pour donner des composés carbonylés.
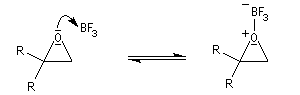
L'ouverture de l'époxyde permet la formation d'un carbocation.
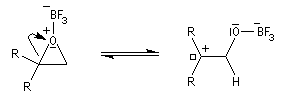
Le système se stabilise par migration d'un atome d'hydrogène et formation d'une double liaison carbone-oxygène.
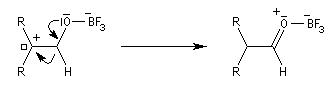
Le catalyseur est régénéré.
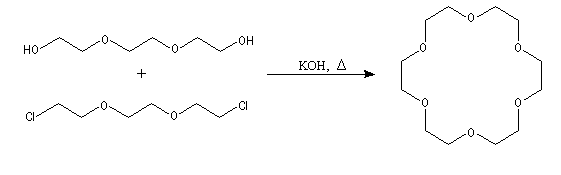
Un éther-couronne peut être caractérisé par le nombre m de chaînons du cycle et le nombre n d'atomes d'oxygène. Il est alors symbolisé par [m]On selon une notation due à Pedersen. Ainsi le composé précédent est le [18]O6 qui se lit : 18-couronne-6 (en anglais : 18-crown-6.) Il est possible de synthétiser des éthers-couronnes de diamètres différents, par exemple [15]O5, [12]O4 ou bien de remplacer les atomes d'oxygène par des atomes de soufre. On obtient ainsi des polythioethers.
C. J. Pedersen (du Pont de Nemours), D. J. Cram (UCLA), J. M. Lehn (Université de Strasbourg) on obtenu le Prix Nobel de chimie en 1987 pour leurs travaux concernant les ligands macrocycliques : éthers-couronnes et macrobicycliques : cryptands.
|
L'image de gauche représente l'éther couronne [18]O6. Dans la nomenclature internationale on le nomme : 1, 4, 7, 10, 13, 16-hexaoxacyclooctadécane. On peut le considérer comme un dérivé cyclique de l'éthane-1,2-diol (éthylèneglycol). A la température ordinaire ce composé se présente sous la forme d'un solide blanc (TF : 37,5 °C). Attention : les éthers couronnes sont des composés toxiques en raison de leur action sur le système nerveux. Ils doivent être manipulés avec précaution. Il faut porter des gants et travailler sous une hotte ventilée. |
Influence de la taille de la couronne
Le diamètre de la cavité de [18]O6 est compris entre 0,26 nm et 0,32 nm. Ce ligand hexadente est une base de Lewis qui forme facilement des complexes avec les ions suivants qui jouent le rôle d'acides de Lewis :
|
Ion |
Rb+ |
NH4+ |
K+ |
|
d/nm |
0,294 |
0,286 |
0,266 |
En revanche Cs+ (0,334 nm) est trop gros tandis que Na+ (0,190 nm) est, au contraire, trop petit. Mais, comme on l'a dit plus haut, il existe des éthers-couronnes de diamètres différents par exemple [15]O5 et [12]O4. [15]O5 complexe Na+ (0,190 nm) et [12]O4 complexe Li+ (0,06 nm).
Transfert de phase
L'expérience suivante illustre la possibilité de transférer des ions en phase organique au moyen de [18]O6.
|
|
|
|
|
I |
II |
III |
A une solution aqueuse de permanganate de potassium KMnO4 (0,1 M) de couleur magenta, on ajoute du toluène (image I). Ce dernier, non miscible à l'eau, constitue la phase supérieure. On ajoute [18]O6 au mélange et on agite vigoureusement pendant au moins deux minutes (image II). Après décantation, on constate que la phase organique est colorée en rose (image III). Les solutions benzéniques de KMnO4 en présence de [18]O6 sont parfois appelées "benzène pourpre".
L'ion K+ couronné est une nouvelle entité de grande dimension qui se comporte comme une molécule dans sa partie périphérique et comme un ion dans sa partie centrale. Ce complexe peut attirer MnO4- par interaction électrostatique tout en conservant une aptitude à se dissoudre en phase organique. K+ couronné permet le transfert de MnO4- de la phase aqueuse à la phase organique. La couleur du mélange évolue ensuite lentement vers le brun qui signale la présence de MnO2 . L'ion MnO4- qui est devenu très oxydant attaque la chaîne latérale du toluène et l'oxyde en acide benzoïque.
Il existe d'autres agents de transfert de phase :Activation anionique
Dans un solvant protique (eau, alcool etc.) les anions sont fortement solvatés car ils contractent avec le solvant des liaisons hydrogène. L'intensité de cette solvatation est d'autant plus importante que l'ion est plus petit et plus chargé.
La nucléophilie est l'aptitude d'une base de Lewis à donner son doublet. Il s'agit d'un concept cinétique. On peut admettre raisonnablement que la couche de solvant entourant un anion solvaté camoufle son cortège électronique externe. C'est, en partie la raison pour laquelle dans ce type de solvants la réactivité nucléophile des anions varie dans l'ordre : I-> Br- > Cl- > F-. Ainsi, il n'est généralement pas possible d'obtenir des composé fluorés par substitution nucléophile bimoléculaire à partir d'un bromure d'alkyle comme substrat même en présence d'un gros excès de KF.
Remarque : en vertu du principe HSAB de Pearson on peut aussi dire que la base dure F- interagit fortement avec l'acide dur S-H constitué par le solvant protique donneur de liaison H.
En revanche la réaction entre le bromo-1-octane et l'ion fluorure s'effectue avec un rendement dépassant 90 % en présence d'éther-couronne [18]O6.
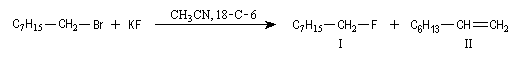
|
Composé |
I |
II |
|
% |
92 |
8 |
L'ion K+ couronné entraîne F- en phase organique dans laquelle la solvatation par liaison hydrogène a disparu. La réactivité nucléophile de cet anion est ainsi fortement exaltée.
L'exemple du dihydropyrane (DHP)
Les éthers d'énols sont des composés bifonctionnels qui combinent la fonction éther avec une insaturation en a de l'atome d'oxygène. Le dihydropyrane est un réactif utile facile à préparer et de coût peu élevé.
|
Le DHP peut être obtenu à partir du 2-hydroxypyrane par une réaction d'élimination en milieu acide.
Il est utilisé notamment comme groupement protecteur de la fonction alcool. |
L'atome de carbone en b de l'atome d'oxygène est enrichi en électrons comme en témoignent les formes mésomères suivantes :
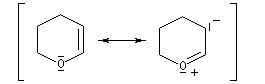
Utilisation du DHP comme groupement protecteur
Le DHP est largement utilisé comme groupe protecteur de la fonction alcool. On utilise une quantité catalytique d'un acide tel que l'APTS. L'acétal formé noté RO(THP) est stable en milieu basique et inactif vis à vis de nombreux réactifs tels que les organométalliques ou LiAlH4. L'exemple suivant illustre l'utilisation de la protection par le DHP dans une synthèse magnésienne.
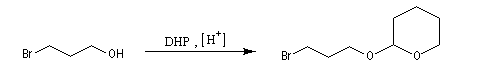
le mécanisme de la protection est le suivant.
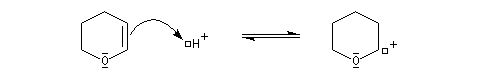
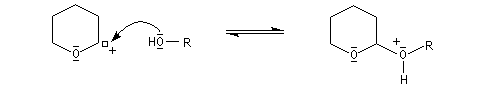
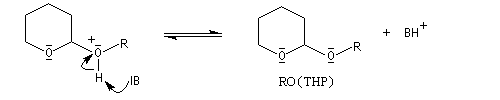
![]()
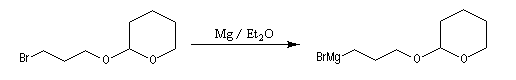
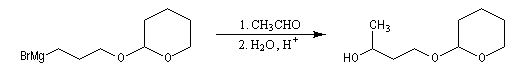
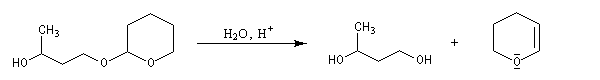
le mécanisme de la déprotection est donné ci-dessous.
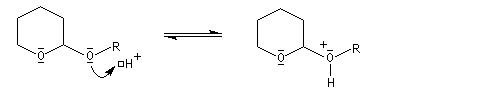
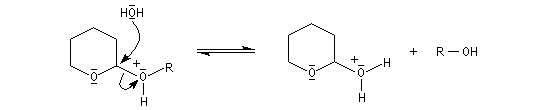
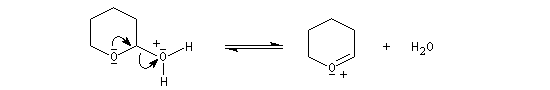
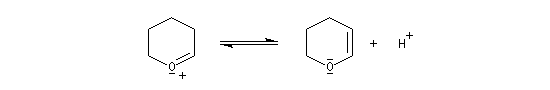
|
|
La montmorillonite K 10 est une argile qui se présente sous la forme d'une poudre de couleur grise de granulométrie très fine et de grande surface spécifique (220-270 m2.g-1). C'est un catalyseur acide qui présente plusieurs propriétés remarquables :
La structure en feuillets des argiles permet une accélération importante de la réaction car les molécules se déplacent dans un plan et non dans l'espace ce qui accroît leur probabilité de rencontre. D'un point de vue technique, le produit étant adsorbé sur l'argile, il est facile de le séparer du mélange réactionnel par simple filtration. |
La protection des alcools chiraux par le DHP présente l'inconvénient de fournir un mélange de diastéréoisomères car un centre chiral est créé au moment de la réaction.
Furane et dérivés substitués
Le furane et ses dérivés substitués peuvent être considérés comme des éthers d'énols. L'hydrolyse en milieu acide conduit à une ouverture du cycle.
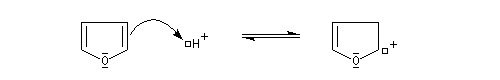
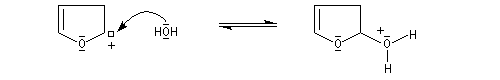
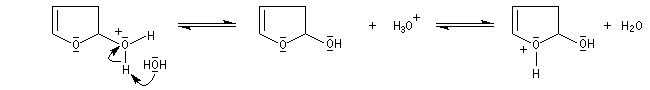
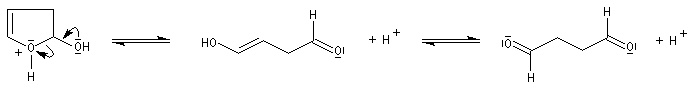
L'hydrolyse acide de dérivés disubstitués du furane est une méthode de préparation des dérivés dicarbonylés 1,4. Comme l'alkylation du furane sur le carbone en a, s'effectue assez facilement (alkylation de l'anion après déprotonation grâce au butyllithium), la méthode constitue un procédé de synthèse utile.
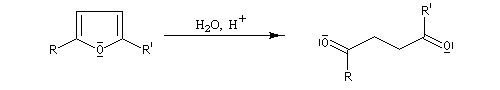
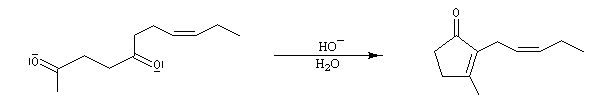
Ce procédé a été mis à profit dans une synthèse de la jasmone (G. Büchi,1966).
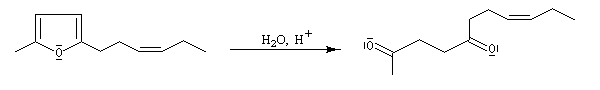
La cyclisation s'effectue grâce à une cétolisation intramoléculaire.
|
liaison |
C-O |
Si-C |
Si-O |
|
Do / kJ.mol-1 |
343 |
372 |
531 |
La réaction entre un éther et l'iodure de triméthylsilyle (TMSI) fournit l'éther de silyle et CH3I. La force motrice de cette réaction vient de la différence entre l'énergie de la liaison Si-O et celle de la liaison C-O.
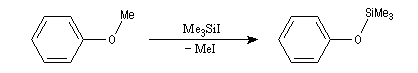
Utilisation comme groupes protecteurs
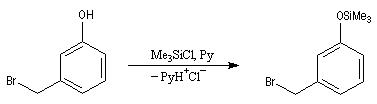
Le tableau suivant regroupe quelques exemples de groupement protecteurs utilisés de façon courante en synthèse organique.
|
triméthylsilyle |
t-butylsilyle |
t-butyldiméthylsilyle |
t-butyldiphénylsilyle |
|
TMS |
TBS |
TBDMS |
TBDPS |
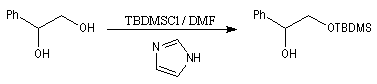
Le fort encombrement des groupes TBDPS et TBDMS constitue un gage de stabilité vis à vis de réactions secondaires comme la réduction ou l'oxydation.
Le clivage des éthers de silyle peut s'effectuer de plusieurs façons :
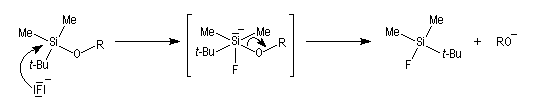
Lors de l'adition diastéréosélective d'un nucléophile sur les faces prochirales d'un groupe carbonyle, un éther de silyle situé en a ne permet pas un contrôle de l'addition par chélation.
Préparation
Les éthers d'énols silylés sont des intermédiaires de réaction qui ont acquis une grande importance dans les réactions organiques modernes. L'énolate, obtenu par réaction entre le composé carbonylé et une base forte comme le LDA est piégé sous forme d'éther d'énol par réaction avec le chlorure de triméthylsilyle en présence de Et3N. Un réactif permettant d'effectuer la réaction dans des conditions très douces est l'iodure de triméthylsilyle en présence de (Me3Si)2NH.
|
Un exemple de préparation d'éther d'énol silylé est donné ci-dessous.
|
Application à la bromation régiosélective de composés carbonylés
La cible recherchée est la 2-bromo-6-méthylcyclohexanone P. La bromation directe de la 2-méthylcyclohexanone fournit un mélange d'isomères avec une mauvaise régiosélectivité. L'idée est de préformer l'énolate qui doit réagir. Une base encombrée et très forte comme le LDA arrache l'atome d'hydrogène le plus accessible et fournit l'énolate cinétique E.
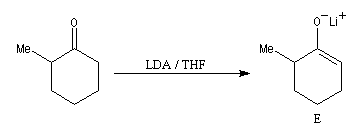
Le piégeage de cet énolate cinétique sous forme d'éther d'énol silylé permet d'éviter son isomérisation en énolate thermodynamique T plus stable qui possède la double liaison la plus substituée.
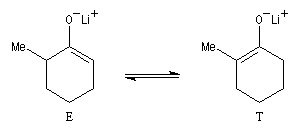
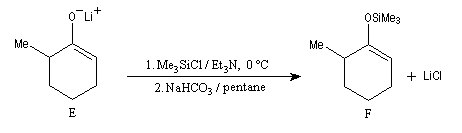
La réaction entre l'éther d'énol et MeLi régénère l'énolate cinétique E. La réaction de ce dernier avec Br2 à basse température est plus rapide que son isomérisation et fournit la cible recherchée P.
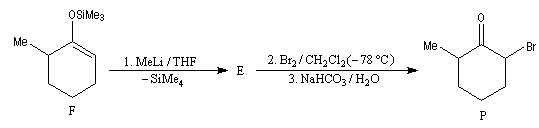
Clivage oxydant
Les éthers d'énols silylés peuvent subir un clivage oxydant sous l'action de la dichlorodicyanoquinone (DDQ). On prépare ainsi des a-énones qui sont des intermédiaires de synthèses précieux [30].
L'exemple suivant concerne la synthèse de la carvone (Fleming et Paterson, 1979) [31].
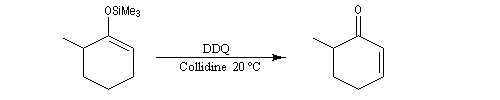
La double liaison exocyclique est introduite grâce à l'addition conjuguée d'un organométallique.
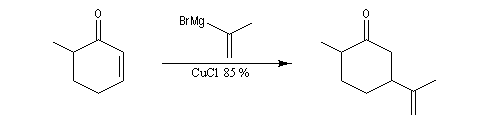
L'énolate thermodynamique est ensuite préparé.
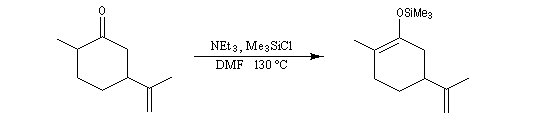
On procède ensuite à un nouveau clivage oxydant.
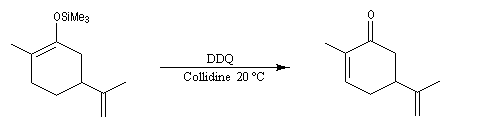
Application à l'alkylation en a de composés carbonylés
On commence par préparer l'énolate cinétique de la méthylcyclohexanone. Ce dernier est ensuite piégé sous forme d'éther d'énol silylé. L'énolate réagit au niveau de l'oxygène avec le chlorure de triméthylsilyle (exemple d'interaction acide dur-base dure).
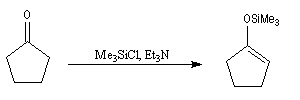
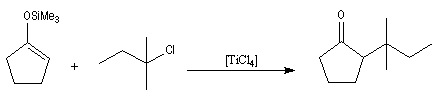
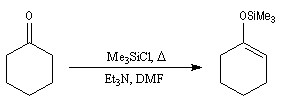
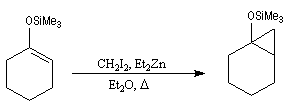
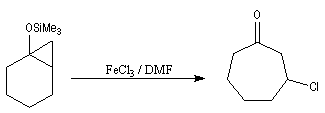
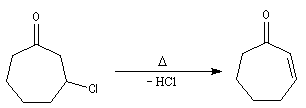
Réaction de Diels-Alder
Les éthers d'énols silylés peuvent être utilisés comme diènes dans la réaction de Diels-Alder. La séquence suivante permet de préparer une dicétone utile en tant qu'intermédiaire de synthèse.
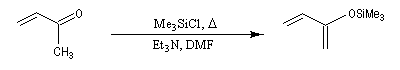
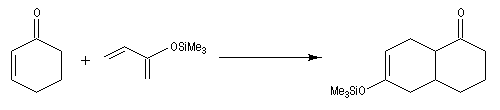
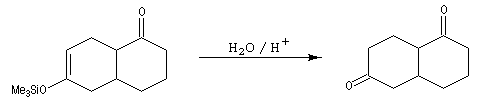
Réaction de Mukaiyama
La réaction de Mukaiyama constitue un type particulier de condensation aldolique entre un éther d'énol silylé et un aldéhyde en présence d'un acide de Lewis comme TiCl4.
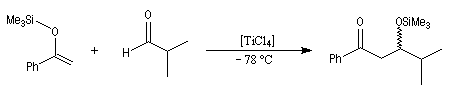
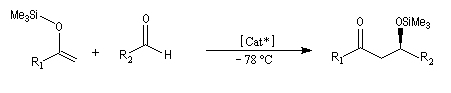
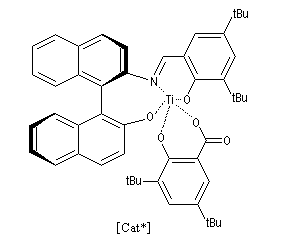
A l'heure actuelle de nombreux travaux sont consacrés à la mise au point de catalyseurs chiraux pour la version asymétrique de la réaction de Mukaiyama. Du fait de son excellente sélectivité, et des rendements généralement élevés qu'elle procure, la réaction est de plus en plus souvent utilisée en synthèse. Voici un exemple de catalyseur. On notera la ressemblance avec le catalyseur de Noyori. Dans l'un et l'autre cas un ligand binaphtyle de symétrie C2 est utilisé.
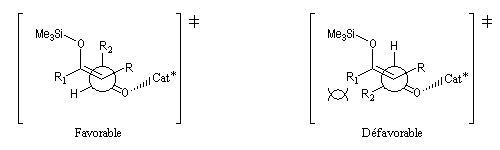
Le mécanisme de la réaction de Mukaiyama est différent de celui d'une condensation aldol ordinaire car le silicium n'est pas un acide de Lewis suffisant pour se coordiner dans un état de transition cyclique de type Zimmerman-Traxler. On observe un état de transition ouvert.
L'état de transition favorisé répond à deux critères :La stéréosélectivité est généralement plus faible qu'avec un état de transition cyclique car la différence d'énergie entre des états de transition ouverts est relativement moins élevée.
Certains composés d'intérêt biologique comportent une fonction éther associée ou non à d'autres fonctions.
|
|
|
|
Disparlure
Le disparlure est une phéromone du bombyx disparate. La synthèse asymétrique de l'énantiomère (+) a constitué l'une des premières grandes applications de l'époxydation énantiosélective de Sharpless.
J. March - Advanced Organic Chemistry (J. Wiley).
N. T. Anh - Introduction à la chimie moléculaire - Cours de l'Ecole Polytechnique (Ellipses 1994).
P. Laszlo - Logique de la synthèse organique - Cours de l'Ecole Polytechnique (Ellipses 1993)
R. Brückner - Mécanismes réactionnels en chimie organique (De Boeck 1999).
Ouvrages axés sur la partie expérimentale
M. Chavanne, A. Jullien, G. J. Beaudoin, E. Flamand - Chimie organique expérimentale (2ed, 1991 - Modulo).
L. F. Fieser et K. L. Williamson (fifth edition 1983 D. C. Heath ans Co)
[18] The Nobel Prize in Chemistry 1987
[18] purification du THF
[18] 18-Crown-6 by George W. Gokel, Donald J. Cram, Charles L. Liotta, Henry P. Harris, and Fred L. Cook.
[18] o-Eugenol by C. F. H. Allen and J. W. Gates, Jr.
[18] Ring expansion of Cycloalkanone by Yoshihiko Ito, Shotaro Fujii, Masashi Nakatuska, Fumio Kawamoto, and Takeo Saegus
[18] a-tert-alkylation of ketones by M. T. Reetz, I. Chatziiosifidis, F. Hübner, and H. Heimbach
[18] Désymétrisation d'époxydes Thèse M. P. Nury
[18] Introduction à la chimie supramoléculaire Teodor Silviu Balaban, Université d' Aix-Marseille III, „Paul Cezanne“; Karlsruhe Institute of Technology
[18] The Discovery of Crown Ethers, Nobel Lectures 1987 by Ch. Pedersen
[18] Epoxide Migration (Payne rearrangment) and related reactions by M. Manson.
[18] Mukayama Aldol reaction by Lu Kui, 2005.
[18] Protection et déprotection Ecole Polytechnique.
[18] Morphogénèse chimique : topochimie (lien 21) Cours du Prof. J. Livage (Collège de France) (jolies photos sur l'utilisation de [18]O6 comme catalyseur de tranfert de phase...)
[19] Utilisation des peroxydes organiques ; fiche éditée par l'INRS.
[30] I. Paterson, C.J. Cowden, V.S. Rahn, M.D Woodrow, Synlett 8, 915-917, Thieme, 1998
[31] I. Paterson, I. Fleming, Synthesis 1979, 736.
[32] T. Mukaiyama et al, J. Am. Chem. Soc. 96, 7503 (1974).
[33] E. Carreira, J. Am. Chem. Soc. 1994, 116, 8837.
[34] A. Gorgues - Activation anionique à l'aide d'ammonium quaternaires, d'éthers couronnes et de dérivés analogues BUP 595, Juin 1977.
[35] Payne, G. B. J. Org. Chem. 1962, 27, 3819.
[36] Chalmers et al., J. Chem. Soc. 1949, 3424.
Vous pouvez, si vous le souhaitez, utiliser le contenu de cette page dans un but pédagogique et non commercial.
Texte, dessins, photographies : Gérard Dupuis - Lycée Faidherbe - LILLE
avril 2014