Cours de chimie Organique - G. Dupuis - Lycée Faidherbe de Lille
Représentation des molécules
Stéréodescripteurs
Règles séquentielles de R. S. Cahn, C. Ingold, V. Prelog
La constitution d'une entité moléculaire précise la nature et les modes d'union des atomes formant cette entité, en incluant la multiplicité des liaisons sans tenir compte de leur disposition dans l'espace.
La configuration d'une entité moléculaire est la disposition spatiale des atomes ou des groupes d'atomes de cette entité. Ce terme est propre aux stéréo-isomères dont l'isomérie n'est pas due à des différences de conformations.
Les stéréo-isomères de configuration peuvent être classés en fonction de critère de symétrie. On distingue alors :
Modes de représentation des molécules
Représentation en perspective & représentation de Cram
La représentation de Cram introduite par le chimiste américain D. J. Cram (UCLA) en 1953, utilise les conventions résumées ci-dessous pour le dessin des liaisons.
|
dans le plan |
en avant du plan |
en arrière du plan |
stéréochimie non définie |
|
trait simple |
trait gras |
trait pointillé. |
trait ondulé |
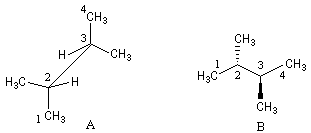
Le dessin suivant représente l'un des stéréoisomères du 2, 3-diméthylbutane en utilisant la représentation perspective cavalière (en anglais : sawhorse) (A) et la représentation de Cram (B).

|
Le (-)-menthol ou menthol lévogyre, est le : Ce composé existe à l'état naturel dans l'essence de menthe. Le (-)-menthol est un composé important de l'industrie des arômes et des parfums. Sa synthèse industrielle à partir du myrcène peut être réalisée selon un procédé très élégant mis au point par la société Takasago dans lequel l'étape clé est une isomérisation énantiosélective mettant en jeu un catalyseur de Noyori. |
Des exemples un peu plus compliqués sont fournis par les cis et trans décalines et le cholestérol.
Donald J. Cram a été lauréat du prix Nobel de chimie en 1987 (conjointement avec J. M. Lehn et J. C. Pedersen) pour ses travaux concernant les complexes moléculaires de type "host-guest" tels que les éthers-couronnes et les cryptands [36].
Représentation de Haworth
Ce mode de représentation, introduit par le chimiste britannique Sir N. Haworth, est fréquemment utilisé dans la chimie des sucres et de leurs dérivés. Il est beaucoup plus commode que la représentation de Fischer dans le cas des structures cycliques. Les exemples ci-dessous, qui concernent les hémiacétals cycliques du glucose, montrent la filiation entre cette représentation et celle utilsant un cycle cyclohexanique en perspective qu'on utilise de plus en plus fréquemment à l'heure actuelle. On a représenté successivement :
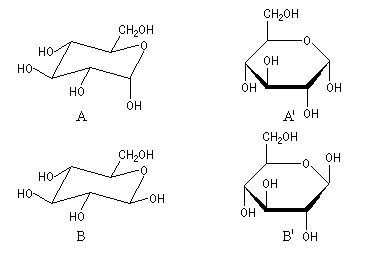
La structure de l'ATP offre un exemple d'utilisation de ce mode de représentation. Le cycle central est celui d'un ribofurannose.
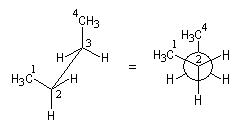
Projection de Newman
Cette technique de projection porte le nom du chimiste américain Melvin Spencer Newman (Ohio University) qui l'a introduite en 1952. La molécule est dessinée en projection selon une liaison C-C perpendiculaire au plan du papier [18].
L'exemple suivant est celui de la molécule de butane en projection selon C2-C3.
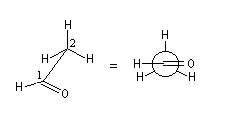
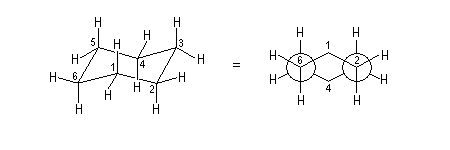
Projection de Fischer
Le chimiste allemand E. Fischer (prix Nobel 1902) à qui l'on doit notamment la détermination de la stéréochimie complète du glucose, ainsi que le modèle "clé-serrure" (en anglais : lock-key) est le créateur d'un mode de représentation très utilisé dans la chimie des sucres [32]. Les conventions sont les suivantes :
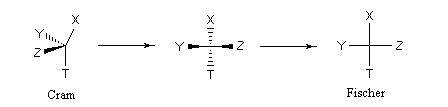
Configuration absolue
Définition Règles de R. S. Cahn, C. Ingold, V. Prelog
On appelle configuration absolue, la disposition spatiale des atomes ou des groupes d'atomes d'une entité moléculaire chirale ou d'un groupe chiral qui distingue cette entité ou ce groupe de son image dans un miroir. La configuration absolue est décrite par des stéréodescripteurs conventionnels.
C'est en 1966, lors de la conférence de Buerguenstock en Suisse, que Cahn, Ingold et Prelog s'engagèrent à utiliser les règles qui portent leurs noms dans tous les articles scientifiques traitant de stéréochimie [30].
Dans la molécule de bromochlorofluorométhane CHBrClF, les atomes entourant le carbone central sont classés dans l'ordre suivant : Br > Cl > F > H.
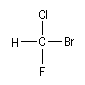
Si l'on on veut comparer les priorités des atomes de carbone des groupes éthyle (I) et méthyle (II) :
![]()
|
Groupe |
I |
II |
|
rang 1 |
(C, H, H) |
(H, H, H) |
Le groupe I est prioritaire sur le groupe II.
Soit à comparer les atomes de carbone du groupe 2-méthylpropyle et du groupe butyle :

|
Groupe |
I |
II |
|
rang 1 |
(C, H, H) |
(C, H, H) |
|
rang 2 |
(C, C, H) |
(C, H, H) |
le groupe I est prioritaire sur le groupe II.
Si l'on veut comparer les atomes de carbone des groupes I et II :
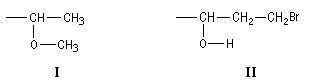
au premier rang, on a deux séries (O, C, H) identiques et on ne peut conclure.
On compare alors les branches prioritaires correspondant à la bifurcation de l'atome d'oxygène. Le premier groupement est prioritaire sur le deuxième car l'atome de carbone l'emporte sur l'atome d'hydrogène.
Exemples :
.
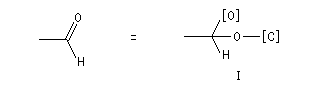
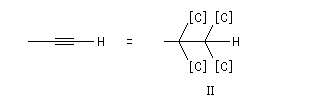
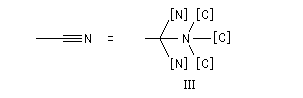
|
Groupe |
I |
II |
III |
|
rang 1 |
C (O, O, H) |
C(C, C, C) |
C(N, N, N) |
On aboutit à l'ordre des priorités suivant :
I > III > II
Stéréodescripteurs R et S d'un centre chiral
Un centre chiral est un atome maintenant un ensemble d'atomes ou de groupes d'atomes dans une disposition non superposable à son image dans un miroir. L'exemple le plus simple de centre chiral est l'atome de carbone lié à 4 groupes différents encore appelé depuis Van't Hoff, atome de carbone asymétrique. Le terme centre chiral s'applique aussi à des structures octaédriques ou ayant
la forme d'une bipyramide trigonale qui ne sont pas forcément asymétriques.
Classons les groupes liés à un atome de carbone asymétrique par ordre de priorité en utilisant les règles séquentielles de Cahn, Ingold et Prelog et supposons qu'après classement on ait :
1 > 2 > 3 > 4
(le signe > signifie : est prioritaire devant).
Un observateur dont l'œil est du côté de l'atome de carbone, regarde dans la direction de la liaison C-4 entre cet atome de carbone et le groupe classé dernier dans l'ordre des priorités. Deux situations peuvent alors se présenter :
|
|
Les substituants défilent par priorité décroissante dans le sens des aiguilles d'une montre. La configuration absolue est R (rectus). |
|
|
Les substituants défilent par priorité décroissante dans le sens inverse des aiguilles d'une montre. La configuration absolue est S (sinister). |
Voici quelques exemples.
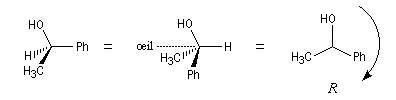
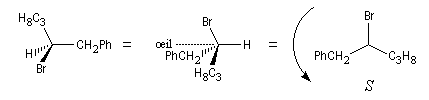
|
O(OH) > C3 > C1 > H |
|
Le (2S)-1-phényl-2-aminopropane (l'un des deux énantiomères de l'amphétamine) est un composé qui possède une action stimulante sur le système nerveux central.
N(NH2) > C1 > C3 > H |
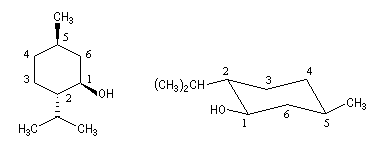
|
Atome |
C1 |
C2 |
C5 |
|
|
R : OH > C2 > C6 > H |
S : C1 > C(iPr) > C3 > H |
R : C6 > C4 > C(CH3) > H |
Configuration et configuration absolue
Le mot configuration désigne la disposition des atomes d'une entité moléculaire dans l'espace sans tenir compte des rotations autour des liaisons simples. La configuration absolue d’une structure dépend de sa configuration et des ordres de priorité des groupements selon les règles séquentielles de Cahn, Ingold et Prelog.
La réaction de substitution bimoléculaire suivante entre un ion alcynure et un dérivé halogéné, s'accompagne d'une inversion de configuration du centre chiral appelée inversion de Walden. En revanche la configuration absolue de la molécule n'est pas modifiée.
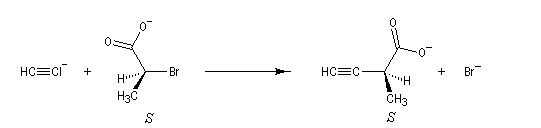
|
Composé |
substrat |
produit |
|
Ordres de priorité |
Br > C(CO2-) > C(CH3) > H |
C(CO2-) > C(CCH) > C(CH3) > H |
Molécules possédant plusieurs centres chiraux
Lorsqu'une molécule possède plusieurs atomes de carbone asymétriques, on donne la configuration absolue de chacun d’eux. Les formules suivantes sont celles des acides tartriques ou (2R, 3R)-2,3-dihydroxybutane-1, 4-dioïque et (2S, 3S)-2,3-dihydroxybutane-1,4-dioïque énantiomères.
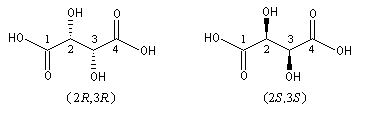
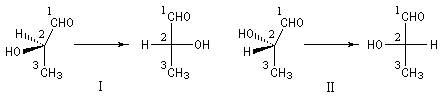
On peut déterminer les configurations absolues rapidement à partir projections de Fischer en utilisant la méthode suivante. Les groupements sont classés suivant les règles séquentielles de Cahn, Ingold et Prelog. Deux cas peuvent se présenter :
La projection de Fischer se prête bien à la représentation et à la classification des stéréoisomères dans la chimie des sucres. Le 2, 3, 4-trihydroxybutanal possède 2 atomes de carbone asymétriques. Il existe deux paires d'énantiomères représentés ci-dessous. Le premier couple est appelé érythrose. Le second est appelé thréose.
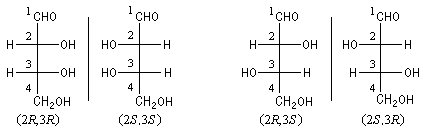
Le glucose naturel est le (2R, 3S, 4R, 5R)- 2, 3, 4, 5, 6-pentahydroxyhexanal. On l'appelle aussi D-glucose en utilisant la nomenclature de Fischer.
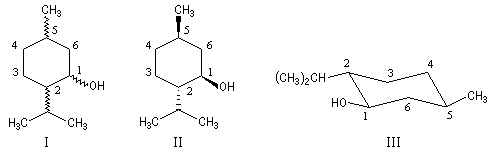
Il est représenté ci-dessous en utilisant successivement la représentation de Cram (I) et (II) et la projection de Fischer (III).
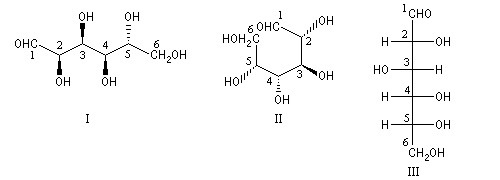
Remarque : en solution aqueuse, le glucose existe principalement sous forme d'hémiacétals cycliques, glucopyranose b et glucopyranose a essentiellement.
On pourra aussi examiner le cas des acides (2R)-2-hydroxypropanoïques et (2S)-2-hydroxypropanoïques (acides lactiques) ainsi que celui du menthol c'est à dire le (1R, 2S, 5R)-5-méthyl-2-isopropylcyclohexanol.
Pseudo-asymétrie
Il existe quatre stéréoisomères de la molécule de trihydroxy-2, 3, 4-pentanedioïque. Ces stéréoisomères peuvent être classés en un couple d'énantiomères et deux formes méso. Dans les stéréoisomères III et IV, l'atome C3 est substitué
par deux atomes de constitution identique mais de configuration absolue différente. Il est dit pseudo-asymétrique. Sa configuration absolue est notée en minuscule.
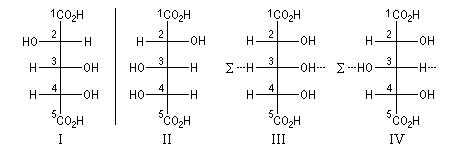
On utilise les règles supplémentaires suivantes :
|
Molécule |
I |
II |
III |
IV |
|
Configuration absolue |
(2S, 4S) |
(2R, 4R) |
(2R, 3r, 4S) |
(2R, 3s, 4S) |
Nomenclature de la chiralité axiale
La molécule est observée selon l'axe de chiralité. On adopte les règles suivantes :
Le résultat est indépendant de la façon dont est placée la molécule.
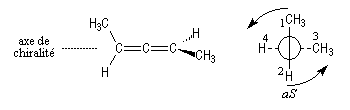
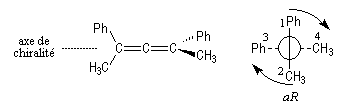
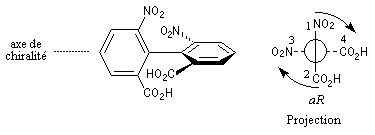
Configurations relatives
Définitions
On appelle configuration relative la configuration de tout groupe stéréogène par rapport à tout autre groupe stéréogène contenu dans la même entité moléculaire.
À la différence de la configuration absolue elle est inchangée par réflexion.
Configuration relative autour d'une double liaison
Les atomes de carbone et les atomes qui leurs sont liés, engagés dans une double liaison constituent des groupes stéréogènes. Considérons le plan passant par les atomes de carbone de
la double liaison et perpendiculaire au plan passant par les groupes qui lui sont liés. Ces groupes sont situés au dessus et au dessous de ce plan.
|
Relation |
cis |
trans |
|
Groupes |
a et c ; b et d |
b et c ; a et d |
Les termes cis et trans sont relatifs et peuvent être ambigus lorsqu'on les utilise pour nommer une entité moléculaire.
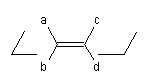
Stéréodescripteurs Z et E
Les groupes portés par chaque carbone sont classés par priorité décroissante en utilisant les règles séquentielles de Cahn, Ingold et Prelog. Supposons qu'on ait :
a > b et c > d
Deux situations se présentent selon que les groupes prioritaires sont situés du même côté du plan passant par les atomes de carbone ou de part et d'autre de ce plan :
La première configuration est appelée Z (zusammen) la deuxième est appelée E (entgegen) ;
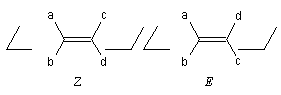
il existe deux stéréoisomères du but-2-ène :

le dessin suivant représente la molécule de (10E, 12Z)-hexadéca-10,12-diène-1-ol.
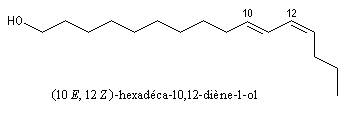
|
Le bombykol est une phéromone sexuelle du Bombyx du mûrier. A. F. J. Butenandt et coll. (Allemagne) en ont obtenu 12 mg à partir d'un demi-million d'insectes. L'identification de ce composé (1959) a demandé plus de 20 années de recherches. La stéréochimie a été prouvée en comparant l'activité biologique des différents isomères, obtenus par synthèse avec celle du bombykol naturel. |
Un autre exemple de phéromone est donné par le disparlure premier composé de ce type à avoir été identifié.
Configurations relatives de molécules possédant deux centres chiraux Couples (R, R) et (S, S) (R, S) et (S, R) Notation R*R* ou like R*S* ou unlike
Il s'agit de préciser la configuration relative d'un centre chiral par rapport à un autre centre chiral. Les stéréodescripteurs utilisés sont like et unlike, [16], [17].
L'exemple ci-dessous concerne les isomères du 2, 3, 4-trihydroxybutanal.
|
Couples |
|
|
|
Notations |
like |
unlike |
Stéréodescripteurs érythro et thréo
Lorsqu'une molécule possède deux atomes de carbone asymétriques, il existe au maximum 4 stéréoisomères qu'on peut grouper
en deux couples d'énantiomères, sauf dans le cas où il existe un composé méso achiral.
On distingue ces couples par les notations érythro et thréo. Cet ancienne nomenclature trouve son origine dans l'étude des stéréoisomères du 2, 3, 4-trihydroxybutanal. Ces sucres peuvent être regroupés en deux couples d'énantiomères appelés respectivement érythrose et thréose.
On s'intéresse aux groupes portés par les atomes asymétriques C2 et C3. Les groupes sont classés selon les règles de priorité de Cahn, Ingold et Prelog. La molécule est observée en projection de Newman :L'exemple suivant concerne les stéréoisomères du 2-bromo-3-fluorobutane.
|
Couples |
|
|
|
Notations |
érythro |
thréo |
Stéréodescripteurs syn et anti syn syn anti anti La nomenclature recommandée par l'UICPA pour la description des configurations relatives fait intervenir les stéréodescripteurs like et unlike. Cependant l'utilisation des stéréodescripteurs syn et anti est très employée du fait de sa simplicité pour décrire la stéréochimie des adduits dans de nombreuses réactions classiques comme la condensation aldol. Cas des sucres Projection du groupement -OH à droite à gauche Série D L
La chaîne carbonée principale dessinée en zig-zag est inscrite dans un plan. Les substituants sont en dessous ou au dessus de ce plan.
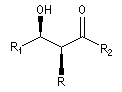
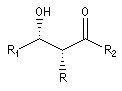
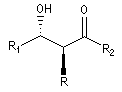
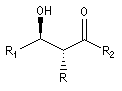
La molécule est représentée en utilisant la projection de Fischer. On s'intéresse au groupe -OH situé sur le dernier atome asymétrique. Cet atome est donc différent selon le nombre d'atomes de la chaîne carbonée.
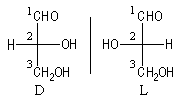
Le (2R)-2-hydroxypropanal (2R-glycéraldéhyde) et son énantiomère le (2S)-2-hydroxypropanal (2S-glycéraldéhyde) sont représentés ci dessous. Le seul atome de carbone asymétrique est l'atome 2. Le composé 2R appartient à la série D, tandis que le composé 2S appartient à la série L.
. 
Pour les 2, 3, 4-trihydroxybutanals stéréoisomères (éryhtrose et thréose), il faut s'intéresser à la configuration du carbone 3. On a les résultats suivants :
|
Configuration absolue |
(2R, 3R) |
(2S, 3S) |
(2R, 3S) |
(2S, 3R) |
|
Série |
D |
L |
L |
D |
La stéréochimie de l'atome de carbone 5 montre que le glucose naturel appartient à la série D.
Origine de la nomenclature D, L
Deux composés énantiomères ont des pouvoirs rotatoires opposés. Faute de pouvoir déterminer la géométrie des deux glycéraldéhydes énantiomères, Fischer décida arbitrairement (il avait une chance sur de deux de trouver le bon résultat) que le composé dextrogyre était celui représenté à gauche sur le dessin précédent et il lui attribua la configuration D. Du même coup, l'énantiomère lévogyre devait être le composé L.
Quand en 1951 J. M. Bijvoet détermina expérimentalement, par une méthode spéciale de diffraction des rayons X, la structure d'un dérivé de l'acide (+)-tartrique, on pu connaître par corrélation de configuration celle du (+)-glycéraldéhyde. On constata que l'hypothèse qu'avait faite Fischer était la bonne.
Il n'existe cependant aucune relation générale entre la configuration D ou L d'une molécule et le signe (+) ou (-) du pouvoir rotatoire du composé. Certains composés appartenant à la série D sont lévogyres, d'autres de la série L sont dextrogyres (l'alanine naturelle par exemple).
On peut se rappeler qu'un composé de configuration D possède un groupe OH qui se projette à Droite en projection de Fischer.
Cas des aminoacides
La molécule est représentée en projection de Fischer. On s'intéresse au groupe amino porté par le premier atome de carbone asymétrique.
|
Projection du groupement -NH2 |
à droite |
à gauche |
|
Série |
D |
L |
L'alanine naturelle est l'acide (2S)-2-aminopropanoïque. C'est un aminoacide appartenant à la série L.
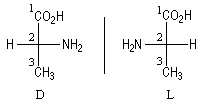
Il est préférable d'utiliser les règles de Cahn, Ingold et Prelog plus systématiques mais il faut connaître cette nomenclature en raison de l'abondante littérature existante.
Prochiralité
Atomes prochiraux
Commençons par étudier l'exemple de la molécule d'éthanol (1). Un observateur est capable de distinguer les atomes d'hydrogène HA et HB en repérant leur position par rapport aux autres atomes de la molécule c'est à dire en utilisant une référence interne. Cette observation
peut être généralisée. Dans ce but, K. Mislow et M. Raban ont introduit un nouveau concept, celui de prochiralité (voir [19] et [35].)
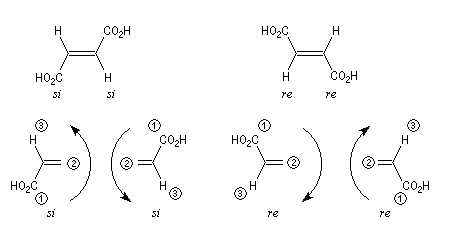
Remplaçons chaque atome d'hydrogène successivement par un atome de deutérium. Nous obtenons respectivement les molécules (2) et (2') énantiomères.
Nous dirons que les atomes HA et HB sont énantiotopiques.
|
Atomes d'hydrogène énantiotopiques de la molécule d'éthanol.
Notons que ces protons énantiotopiques peuvent être discernés par un réactif chiral tel que l'alcool déshydrogénase. |
Considérons à présent une molécule dans laquelle le groupe méthyle est remplacé par un groupe asymétrique noté R*. Le remplacement des atomes HA et HB par un atome de deutérium conduit cette fois à deux molécules (2) et (2') diastéréo-isomères. Les atomes HA et HB sont dits diastéréotopiques.
|
Atomes d'hydrogène diastéréotopiques de la molécule de bromofluoroéthanol.
|
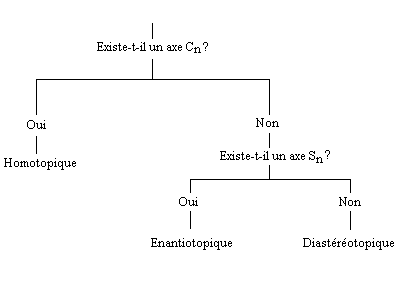
Groupes prochiraux et symétrie
On peut classer les groupes prochiraux en utilisant des critères de symétrie. Deux groupes homotopiques ou équivalents
sont échangeables par une opération de rotation Cn autour d'un axe. Ils sont stéréohétérotopiques dans le
cas contraire.
|
Effet d'une rotation Cn |
superposables |
non superposables |
|
Nature des groupements |
homotopiques |
stéréohétérotopiques |
Dans l'exemple suivant la molécule possède un axe de symétrie C2. La rotation de 180° autour de l'axe D échange les groupes G homotopiques :
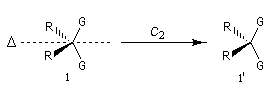
Les groupes stéréohétérotopiques sont classés en deux sous-catégories : les groupes énantiotopiques sont échangeables par une opération de symétrie Sn. Autrement dit, ils sont échangeables par une opération de symétrieimpliquant les éléments suivants :
Des groupes diastéréotopiques ne sont pas échangeables par une opération de symétrie.
|
Effet d'une symétrie Sn |
superposables |
non superposables |
|
Nature des groupements |
énantiotopiques |
diastéréotopiques |
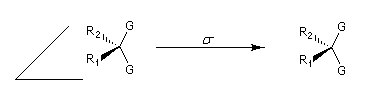
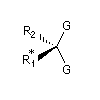
Nomenclature des groupes prochiraux
Rendons arbitrairement prioritaire l'un des groupes par rapport à
l'autre et classons les groupes en utilisant les règles de Cahn, Ingold et Prelog. S'il s'agit de deux atomes d'hydrogène on peut remplacer l'un d'eux par un atome de deutérium (méthode de Hirschmann.) Deux cas peuvent alors se
présenter :
Exemple : les atomes d'hydrogène de la molécule de NADH sont prochiraux.
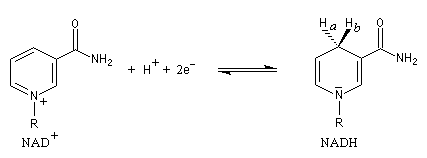
|
Atome |
Ha |
Hb |
|
Stéréodescripteur |
pro-S |
pro-R |
Faces prochirales
Le concept de prochiralité peut être étendu aux atomes trigonaux dont l'environnement est localement plan. On peut alors distinguer deux faces.
Raisonnons sur l'exemple du groupe carbonyle du
benzaldéhyde. L'addition de l'ion cyanure (groupe achiral) sur cette molécule, suivie d'une acidification, peut s'effectuer avec une égale probabilité sur l'une ou l'autre des
deux faces du groupe carbonyle. Cela conduit aux hydroxynitriles I et II énantiomères. On dit que les faces du groupe carbonyle
sont énantiotopiques.
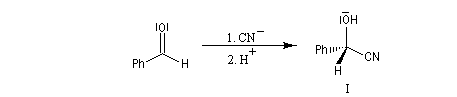
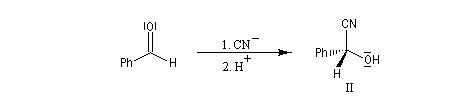
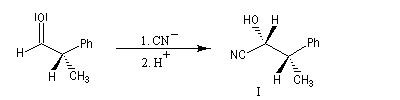
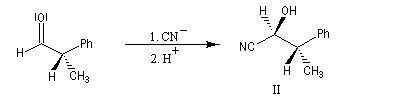
Remarque : l'existence d'un centre chiral en a du groupe carbonyle pose un problème d'induction asymétrique. La règle de Cram ainsi que les modèles plus élaborés de Felkin et de Felkin-Anh sont examinés dans le chapitre consacré à la stéréochimie dynamique.
Faces prochirales et symétrie
Considérons à présent un atome de carbone impliqué dans une double liaison. Les liaisons qu'il développe appartiennent à un même
plan. Ce dernier partage l'espace en deux parties. On distingue trois cas :
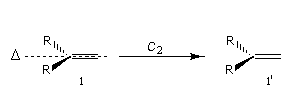
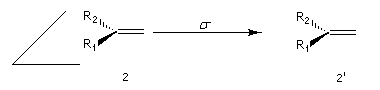
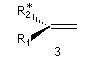
Nomenclature des faces prochirales
Une nomenclature des faces prochirales a été proposée K. R. Hanson [20] ; [35] et [37]. Elle est basée sur une généralisation des conventions de Cahn Ingold et Prelog. Les
groupes sont classés dans l'ordre des priorités décroissantes :
1 > 2 > 3
|
|
|
|
|
|
Exemple 1 : benzaldéhyde
|
|
|
Exemple 2 : acide fumarique
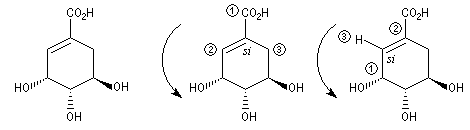
|
|
L'acide (-)-shikimique ou acide (3R,4S,5R)-3,4,5-trihydroxycyclohex-1-ène-1-carboxylique) est extrait de la badiane de chine ou anis étoilé. Il peut aussi naturellement être obtenu de façon synthétique [39]. Ce composé d'origine naturelle sert de point de départ à l'hémisynthèse stéréosélective du Tamiflu, un antiviral [40]. |
Bibliographie
Ouvrages théoriques
[1] J. March - Advanced organic chemistry, Wiley Interscience.
[2] F. A. Carey, R.J. Sundberg - Advanced organic chemistry, 3d edition (Plenum Press, 1990).
[3] André Collet, Jeanne Crassous, Jean-Pierre Dutasta, Laure Guy. Molécules chirales : stéréochimie et propriétés. EDP Sciences, CNRS Editions.
[4] Enantiomers, racemates, and resolutions, Jean Jacques, André Collet, Samuel H Wilen 1981.
[5] H. Kagan - La stéréochimie organique (PUF, 1975).
[6] E. L. Eliel, S. H. Wilen, Stéréochimie des composés organiques (Tec et Doc).
[7] J. L Pierre - Principes de stéréochimie organique statique (A. Colin, 1971).
[8] A. Kirmann, J. Cantacuzène, P. Duhamel - Chimie organique T 1 (A. Colin, 1971).
[9] K. Mislow - Introduction to stereochemistry (W. A Benjamin, New York, 1966).
[10] J. Jacques - La molécule et son double (Hachette, 1992).
Liens
[30] Systematic Stereochemical Nomenclature & Vladimir Prelog
[31] Glossary of terms used in physical organic chemistry IUPAC recommendations 1994.
[32] E. Fischer, The Nobel Prize in Chemistry 1901
[33] Sir N. Haworth, The Nobel Prize in Chemistry 1937
[34] A. Butenandt, The Nobel Prize in Chemistry 1939
[34] Chemtube 3D (University of Liverpool)
[35] The Four Big Cs of Organic Structure Composition, Constitution, Configuration, Conformation
[36] Nobel prize in chemistry 1987
[37] Prostereoisomerism and the Concept of Product Stereose by Bernard Testa Department of Pharmacy, Lausanne University Hospital (CHUV), Rue du Bugnon, CH-1011 Lausanne
[38]
Other Stereogenic Elements: Axes of Chirality, Planes of Chirality, Helicity, and
(E,Z)-Diastereoisomerism by Bernard Testa Department of Pharmacy, Lausanne University Hospital (CHUV), Rue du Bugnon, CH-1011 Lausanne
[39] Chemical Synthesis of Shikimic Acid by Narendra Ambhaikar Scrippps Research Institute
[40] Chemical Synthesis of Tamiflu by Emily Campbell
Vous pouvez, si vous le souhaitez, utiliser le contenu de cette page dans un but pédagogique et non commercial.
Gérard Dupuis - Lycée Faidherbe - LILLE
juillet 2018