|
|
Cours de chimie Organique. G. Dupuis - Lycée Faidherbe de Lille
Eléments d'analyse conformationnelle
Définitions
Les stéréoisomères peuvent être classées selon leur mode d'interconversion :
On peut aussi classer les stéréoisomères en deux catégories selon des critères de symétrie. On distingue :
L'éthane est le deuxième terme de la série des alcanes. Sa molécule a pour formule brute C2H6.
|
|
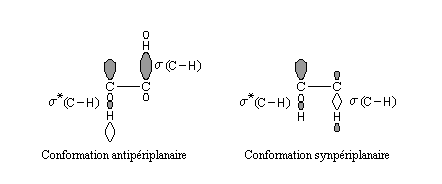
L'étude de la capacité thermique molaire de l'éthane en fonction de la température, montre que la rotation autour de C1C2 n'est pas parfaitement libre. Parmi l'infinité des conformations possibles, deux d'entre-elles possèdent une géométrie remarquable :
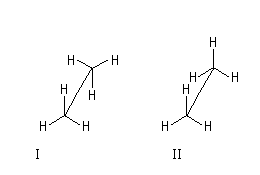
|
q (deg) |
0 |
60 |
|
Conformation |
II |
I |
|
Stéréodescripteur |
synpériplanaire (éclipsée) |
antipériplanaire (décalée) |
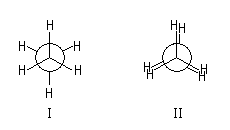
La conformation décalée et la conformation éclipsée ne possèdent pas la même énergie. L'énergie potentielle de la molécule en fonction de l'angle dièdre q entre les liaisons C- H a l'allure suivante :
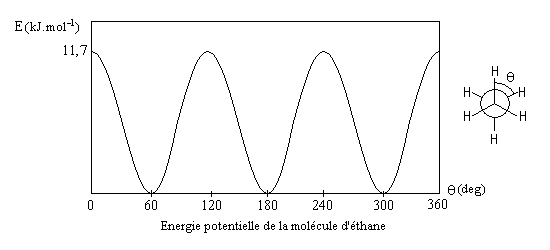
L'énergie potentielle de l'éthane a été étudiée d'un point de vue théorique par R. M. Pitzer et W. N. Lipscomb [9]. On peut en donner une expression quantitative approchée :
![]()
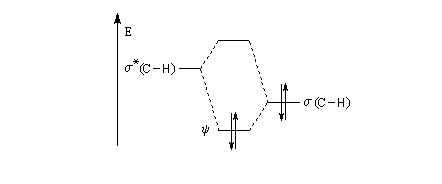
Des calculs récents menés par Lionel Goodman et Vojislava Pophristic (Rutgers University) montrent que la préférence pour la conformation décalée peut être interprétée par un effet d'hyperconjugaison [2] et [25]. En termes d'orbitales moléculaires le résultat précédent peut être retrouvé à partir de l'examen des orbitales frontières :
Butane
Le butane, dont la formule brute est C4H10 est le quatrième terme de la série des alcanes.
|
|
La rotation autour de C2C3 n'est pas parfaitement libre. Les conformations suivantes possèdent une géométrie remarquable :
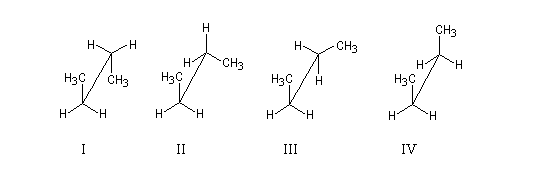
les conformations sont désignées en utilisant les stéréodescripteurs introduits par Klyne et Prelog :
|
q (deg) |
0 |
60 |
120 |
180 |
|
Conformation |
IV |
III |
II |
I |
|
Nom |
synpériplanaire |
synclinale |
anticlinale |
antipériplanaire |
la courbe donnant l'énergie potentielle de la molécule en fonction de l'angle dièdre q entre les liaisons C-CH3 a l'allure suivante :
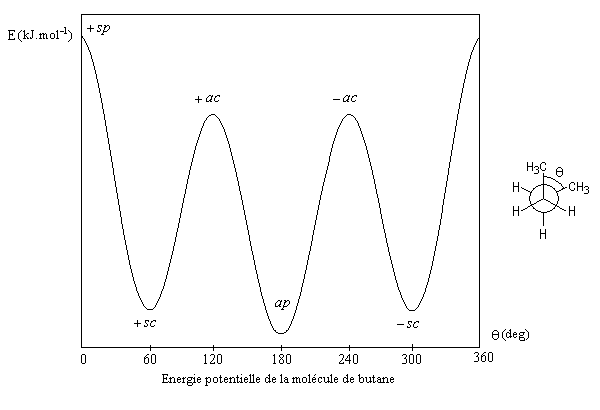
|
q (deg) |
0 |
60 |
120 |
180 |
|
Energie (kJ.mol-1) |
18,8 |
3,8 |
15,9 |
0 |
Pour une étude détaillée de l'analyse conformationnelle des alcanes linéaires, voir [20].
Autres alcanes linéaires
On peut reconnaître les enchaînements carbonés des molécules précédentes dans de nombreuses structures organiques. Le polyéthylène est obtenu par polymérisation de l'éthène (éthylène). Ses chaînes sont constituées de la succession de milliers de motifs -CH2-CH2-. Il existe deux grandes méthodes de polymérisation de l'éthène :
|
La macromolécule est constituée d'un enchaînement régulier d'atomes de carbone dont la conformation la plus stable est plane et en zigzag. Cette conformation permet aux chaînes de s'approcher très près les unes des autres ce qui explique la densité élevée du polymère si on la compare à celle du polyéthylène ramifié ordinaire. |
Diènes et polyènes
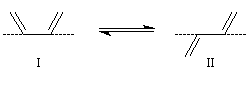
Les conformations dans lesquelles toutes les liaisons sont dans un même plan, sont privilégiées. Elles permettent un recouvrement maximal des orbitales p perpendiculaires au plan du système conjugué. Les stéréodescripteurs s-cis et s-trans se réfèrent à la position des liaisons doubles par rapport
à la liaison simple s.
|
q (deg) |
0 |
180 |
|
Conformation |
I |
II |
|
Stéréodescripteur |
s-cis |
s-trans |
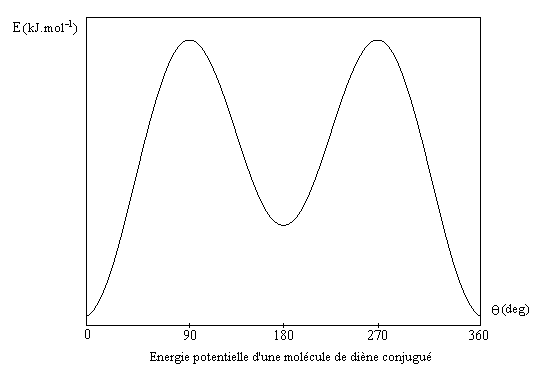
|
q (deg) |
90 |
180 |
|
Energie (kJ.mol-1) |
20,5 |
10,9 |
Il faut noter que bien qu'étant la plus stable, la conformation s-trans n'est pas nécessairement la plus réactive. Dans une réaction de Diels-Alder entre un diénophile tel que le dicyano-1,2-éthène et le buta-1,3-diène le diène réagit dans la conformation s-cis. En vertu du principe de Curtin-Hammett, l'équilibre rapide entre les deux conformations n'intervient pas dans la cinétique de la réaction.
a-énones
La conformation la plus stable est la s-trans.
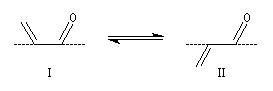
|
q (deg) |
90 |
180 |
|
Energie (kJ.mol-1) |
29,3 |
8,6 |
Cyclohexane
La formule brute du cyclohexane est C6H12. La molécule qui appartient à la famille des cyclanes possède une insaturation. La mesure de la chaleur de combustion indique que la tension dans le cycle est très faible. Comme l'a prédit Sachse dès 1860, la molécule ne doit pas avoir la forme d'un hexagone régulier sinon les angles entre deux liaisons adjacentes seraient 120° et on observerait une contrainte dans le cycle.
Des expériences de diffraction électronique en phase gazeuse ont confirmé que la conformation de plus basse énergie n'est pas plane. On l'appelle : conformation chaise (symétrie D3d.)
Parmi l'infinité des conformations possibles, celles dont la géométrie est remarquable sont classées ci-dessous par énergie croissante :
|
|
|
|
|
|
chaise |
bateau croisé |
bateau |
Enveloppe |
La conformation bateau (symétrie C2v.) possède une énergie supérieure d'environ 30 kJ.mol-1 à la conformation chaise. La conformation bateau est flexible et les contraintes sont plus faibles dans la conformation bateau croisé. La conformation enveloppe, dans laquelle cinq atomes sont dans un même plan, est celle dont l'énergie est la plus haute.
La différence d'énergie entre ces la conformation chaise et la conformation bateau a deux origines :
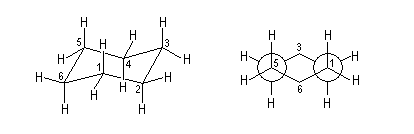
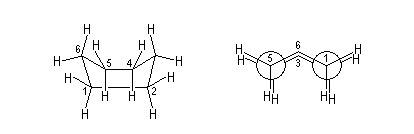
La différence d'énergie entre les conformations chaise et bateau est telle qu'à la température ordinaire 99,9 % des molécules de cyclohexane sont sous forme chaise.
|
Dans cette conformation relativement rigide, les liaisons peuvent être classées en deux catégories :
Modèle interactif de la conformation chaise. |
Dans la conformation bateau, relativement flexible, on distingue quatre catégories de liaisons :
|
La constante de couplage 3JHH entre deux protons vicinaux dépend de la valeur de l'angle dièdre
entre les liaisons C-H. Cette dépendance peut être exprimée quantitativement grâce à la formule de Karplus.
Basculement conformationnel
Le passage d'une conformation chaise à une autre, inverse les positions axiales et équatoriales. A 300 K le passage d'une forme à l'autre s'effectue environ 100 000 fois par seconde.
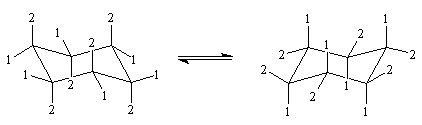
L'existence de deux catégories d'atomes d'hydrogène peut être mise en évidence par spectroscopie RMN si la température est suffisamment basse.
|
|
L'allure du spectre RMN du cyclohexane dépend de la température de travail :
|
La durée de vie t de chaque conformation à la température de coalescence est liée à l'écart Dn entre les déplacements chimiques (exprimé en ppm), par la relation de Gutowsky-Holm [4].
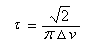
Dérivés monosubstitués du cyclohexane
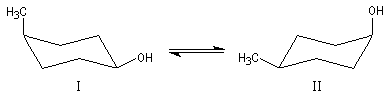
Les dérivés monosubstitués du cyclohexane ont été particulièrement étudiés par D. H. R. Barton et O. Hassel qui ont obtenu le prix Nobel de chimie en 1969. Désignons le substituant par X. Il existe deux conformations chaise en équilibre :
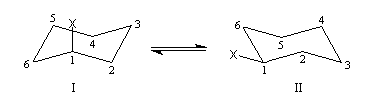
ces conformations possèdent des énergies différentes. La conformation pour laquelle X est équatorial (II) est plus stable que celle dans laquelle X est axial (I). Cela est dû à deux facteurs :
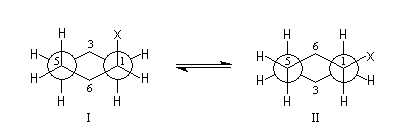
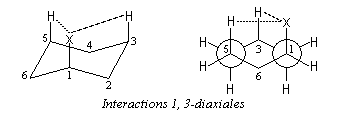
Désignons respectivement par XA et XE, les fractions molaires de I et II. A une température donnée, l'équilibre entre les conformations est caractérisé par une constante K :
![]()
l'opposé de l'enthalpie libre standard de l'équilibre de conformation est appelé préférence équatoriale du groupe X. Cette grandeur est généralement notée A.
A = R.T ln K
On peut déterminer expérimentalement la valeur de A en utilisant différentes techniques, notamment la RMN. Soit P une propriété physique du système en équilibre, par exemple le déplacement chimique du proton porté par l'atome de carbone 1. Supposons que la vitesse d'interconversion soit beaucoup plus rapide que la vitesse de mesure du spectromètre. Celui-ci enregistre alors une grandeur moyenne telle que :Le tableau suivant donne les valeurs de A pour quelques groupes X carbonés. Plus la valeur de A est grande, plus la préférence équatoriale du substituant est prononcée. Des tables plus complètes existent dans la littérature.
|
Groupe X |
méthyle |
isopropyle |
hydroxyle |
tert-butyle |
|
A (kJ.mol-1) |
7,5 |
9 |
3,3 (AcOH 75 %) |
23,5 |
A partir de la valeur de A du méthyle, on montre facilement que le pourcentage de conformère pour lequel le méthyle est équatorial constitue 95 % du mélange à la température ordinaire.
La valeur de A très élevée pour le groupe tert-butyle montre que dans le cas du tert-butylcyclohexane seule la conformation plaçant ce groupe en équatoriale est possible.
|
Le groupe tert-butyle est si volumineux qu'il ne peut exister qu'en position équatoriale. 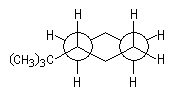 Modèle interactif du tert-butylcyclohexane. |
Les dérivés substitués du tert-butylcyclohexane en position 4 ont souvent été utilisés comme substrats modèles dans l'étude de l'influence de la conformation en stéréochimie dynamique.
Lorsque le cycle est disubstitué, on peut considérer en première approximation que les valeurs de A relatives à chaque substituant sont additives. On peut ainsi déterminer par le calcul la constante d'équilibre de l'interconversion entre les cycles disubstitués.
Comme dans le cas du cyclohexane, la vitesse du basculement conformationnel diminue quand la température diminue. On donne ci-dessous quelques valeurs des temps de demi-réaction t pour l'inversion de conformation du chlorocyclohexane.
|
Température (°C) |
Temps de demi-réaction t |
|
25 |
1,3 10-5 s |
|
-120 |
23 min |
|
-160 |
22 ans |
Lorsque la température est suffisamment basse, le basculement conformationnel est bloqué. Cette propriété a permis en 1966 à F. R. Jensen et C. H. Bushweller de Université de Californie à Berkeley de séparer les conformations avec respectivement un chlore axial et un chlore équatorial [3]. A la température de T = -150 °C, le conformère à chlore équatorial cristallise en premier. Ce solide, une fois isolé, est dissous dans un solvant à cette température. Son spectre RMN est à alors caractéristique du conformère à chlore équatorial. Lorsqu'on élève la température, le spectre de RMN redevient celui du mélange des conformères en équilibre.
Pour l'étude détaillée des cycles à six atomes de carbone, voir [22].
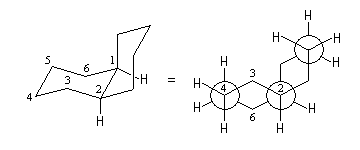
Les décalines sont des hydrocarbures de formule brute C10H18. Ces molécules sont constituées de deux cycles cyclohexaniques accolés. On peut donc les considérer comme des dérivés disubstitués particuliers du cyclohexane.
A partir de l'un des cycles, les liaisons constituant l'amorce du deuxième cycle peuvent être de stéréochimie trans (I) ou bien de stéréochimie cis (II). Le passage de (I) à (II) nécessite la rupture et la reformation de liaisons. Ce sont des isomères de configuration et plus précisément des diastéréo-isomères.
Le cas rappelle celui des diastéréo-isomères cis et trans du 1, 2-diméthylcyclohexane qu'il est conseillé d'étudier avant d'aborder ce paragraphe.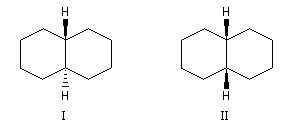
Comme on peut s'y attendre, les décalines possèdent des propriétés physiques et chimiques différentes.
|
Composé |
(trans)-décaline (I) |
(cis)-décaline (II) |
|
TF (°C) |
- 32 |
- 42 |
|
Indice de réfraction (raie D, Na) |
1,4690 |
1,480 |
La nature de la jonction des cycles dans la décaline trans, empêche le basculement conformationnel. La molécule est rigide.
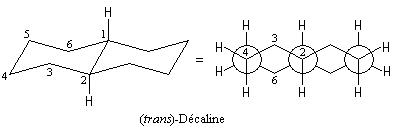
|
Il s'agit donc d'une molécule achirale. |
La situation est différente dans la décaline cis ou la jonction des cycles permet aisément le passage d'une chaise à l'autre. La molécule est flexible.
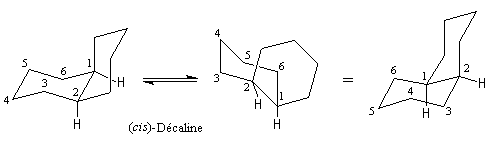
|
|
Notons que la trans décaline est plus stable que la cis décaline. Une estimation qui néglige la contribution entropique, de cette différence de stabilité, consiste à mesurer l'enthalpie standard de la réaction d'isomérisation suivante :
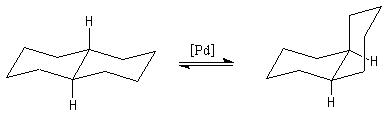
D
rHo = 11,3 kJ.mol-1L'une des causes principales de l'instabilité de la cis décaline par rapport à son isomère trans vient du fait que les atomes d'hydrogène portés par la face concave sont à une distance de 0,217 nm qui est inférieure à la somme de leurs rayons de Van der Waals 0,240 nm.
Stéroïdes
Les stéroïdes sont des composés comportant un squelette carboné constitué d'un système de type phénantrène (cycles A, B, C) avec un cycle cyclopentane accolé (cycle D).
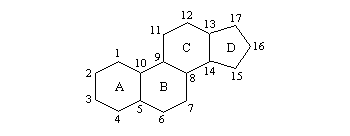
Ce sont des composés extrêmement importants en raison notamment de leurs applications dans le domaine pharmaceutique. Ils sont obtenus par synthèse ou par hémisynthèse à partir de sources naturelles.
Par déshydratation suivie d'une hydrogénation du cholestérol, on peut obtenir deux hydrocarbures diastéréo-isomères représentés ci-dessous. A l'image de ce qui se passe pour les décalines, la jonction entre les cycles A et B est de type trans dans le premier et cis dans le second.
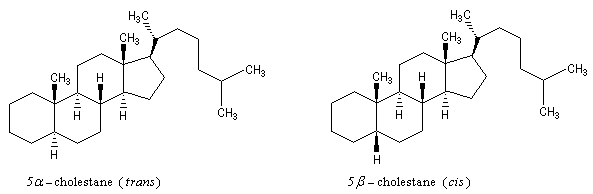
Effet anomère
Lorsqu'on étudie l'équilibre conformationnel des tétrahydropyrannes substitués en position 2 par un groupe électronégatif, on constate que la conformation dans laquelle X est en position axiale est majoritaire à l'équilibre. Ce phénomène porte le nom d'effet anomère.
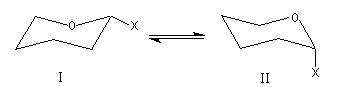
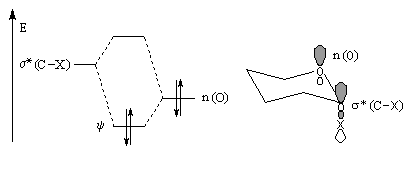
|
|
Pour un bilan détaillé sur le sujet à un niveau avancé, voir [37] et [38].
 |
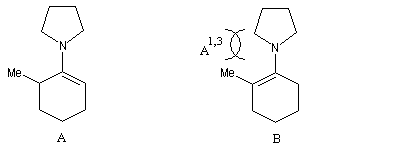
Tension allylique
La tension allylique (en anglais : allylic strain) résulte d'une interaction au sein d'une molécule entre substituants d'une double liaison. L'un de ces substituants étant en position allylique. A l'origine le phénomène a été décrit chez les dérivés substitués du cyclohexène. On distingue deux types appelés respectivement tension allylique A1,2 et tension A1,3 (selon les notations de S. K. Malhotra et F Johnson [8].)
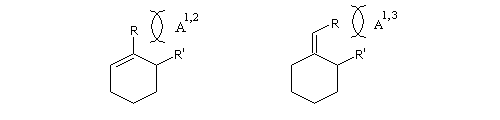
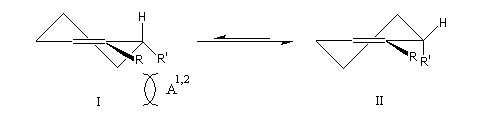
Exemple 1 : dans la conformation I, le substituant R', pseudo-équatorial interagit avec le substituant lié à la double liaison. L'équilibre est déplacé en faveur de la conformation II dans laquelle R' est en position pseudo-axiale.
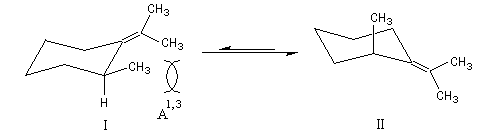
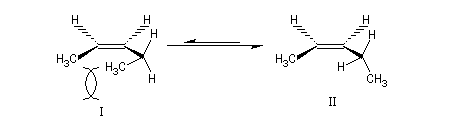
Le phénomène se rencontre également en série acyclique. La conformation II est plus stable que la I.
Pour une étude détaillée de la tension allylique, voir [21].
Systèmes pontés
L'existence du pont permet d'isoler des molécules dans lesquelles un cycle à 6 chaînons adopte les géométries variées rencontrées chez le cyclohexane.
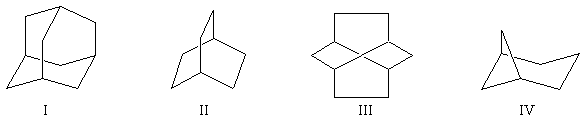
|
molécule |
I |
II |
III |
IV |
|
nom |
bicyclo [2, 2, 2]-octane |
twistane |
bicyclo [3, 1, 1]-heptane |
|
|
cycle |
chaise |
bateau |
twist |
chaise et bateau |
Règle de Bredt
Cette règle d'origine expérimentale affirme l'impossibilité d'existence d'une double liaison en tête de pont d'un composé bicyclique. On en retrouve la manifestation chez certaines cétones bicycliques dont le taux d'énolisation est nul. Lorsque les cycles sont assez grands
il est possible de préparer des composés comportant une double liaison en tête de pont. Le premier composé de ce type a été préparé grâce à la réaction d'aldolisation par Prelog en 1950.
Bibliographie
Ouvrages théoriques
J. March - Advanced organic chemistry, Wiley Interscience.
F. A. Carey, R.J. Sundberg - Advanced organic chemistry, 3d edition (Plenum Press, 1990).
H. Kagan - La stéréochimie organique (PUF, 1975).
J. L Pierre - Principes de stéréochimie organique statique (A. Colin, 1971).
Eliel, E. L., S. H. Wilen, et al. Stereochemistry of Organic
Compounds. Wiley (1994).
D. H. R. Barton, Some recollections of gap jumping (American Chemical Society, 1991).
A. Kirmann, J. Cantacuzène, P. Duhamel - Chimie organique T 1 (A. Colin, 1971).
K. Mislow - Introduction to stereochemistry (W. A Benjamin, New York, 1966).
J. Jacques - La molécule et son double (Hachette, 1992).
V. Pellegrin - Les représentations graphiques bidimensionnelles des molécules en chimie organique (Bulletin de l'Union des Physiciens, février 1999).
Articles
Sur la toile Un cours de D. Evans sur l'analyse conformationnelle en quatre parties
[2] Pophristic, V., and L. Goodman. Hyperconjugation not steric repulsion leads to the staggered structure of ethane. Nature 411 2001, May 31, 565. (voir aussi : [25])
[3] F. R. Jensen, C. H. Bushweller, J. Am. Chem. Soc.91, 3223 (1969).
[4] H. S. Gutowsky and C. H. Holm, J. Chem. Phys. 25. 1228. (1956).
[5] F. Weinhold, Angew. "A New Twist on Molecular Shape" Nature 2001, 411, 539-541.
[6] J. R. Wiseman, J. Am. Chem. Soc. 1967, 89, 5966 (exception Bredt.)
[7] J. A. Marshall, H. Faubl, J. Am. Chem. Soc. 1967, 89, 5965 (exception Bredt.)
[8] Francis Johnson, Sudarshan K. Malhotra J. Am. Chem. Soc., 1965, 87 (23), pp 5492–5493
[9] Pitzer R M and Lipscomb W N, "Calculation of the Barrier to Internal Rotation in Ethane", J. Chem. Phys., 39, 1995-2004 (1963)
(ces quatre cours donnés en 2006, couvrent à un niveau avancé les principaux thèmes de l'analyse conformationnelle.
Ils ont été mis en libre accès par leur auteur : D. A. Evans, professeur à l'Université de Harvard.)
[20] Conformational analysis (I) Ethane, Propane, Butane & Pentane Conformations ; Simple Alkene Conformations
[21] Conformational analysis (II) Introduction to Allylic Strain
[22] Conformational analysis (III) Conformational Analysis of C4 - C6 Rings
[23] Conformational analysis (IV). Ground State Torsional Effects (Conformational Transmission) ; Conformational Analysis of C6 - C8 Rings continued ; Transition State Torsional Effects
[24] Retrosynthesis, Stereochemistry, Conformations M. B. Smith, (Extrait de : Organic Syntheses, University of Connecticut.)
[25] Steric Effects Don't Explain Ethane Conformation
[26] Termes utilisés en stéréochimie Commission générale de terminologie et de néologie (CNRS.)
[27] The principles of conformationnal analysis (Sir D. Barton, The Nobel Prize in Chemistry 1969)
[28] Sir N. Haworth, The Nobel Prize in Chemistry 1937
[29] Derek Harold Richard Barton Biographie sur le site de l'ICSN.
[30] A-values Tableau donnant les valeurs des "préférences conformationnelles" de substituants variés.
[31] Dynamic NMR----
[32] Martin Karplus
[33] K. Ziegler and G. Natta the Nobel Prize in Chemistry 1963
[34] Aspects of the determination of equilibration rates by NMR spectroscopy.
by J. D. Roberts, California Institute of Technology, Pasadena, California, USA.
[35] A synthetic attack on the oestrone problem Woodward, R. B. (Robert Burns), Thesis (Ph. D.)--Massachusetts Institute of Technology, Dept. of Chemistry, 1937.
[36] The Nobel Prize in Chemistry 1969. D. Barton and O. Hassel (la conférence que Barton donna à l'occasion de la remise de son prix Nobel s'intitule : The principles of conformational analysis.)
[37] The Anomeric effect Baran Group, Scripps Research Institute.
[38] The Anomeric effect
Gérard Dupuis - Lycée Faidherbe - LILLE
décembre 2012