|
|
|
|
|
|
Dérivé nitré |
Oxime |
Hydrazone |
Ion diazonium |
|
|
|
|
|
|
Oxyde d'amine |
Azoture |
Diazoalcane |
Nitrone |
Cours de chimie Organique - G. Dupuis - Lycée Faidherbe de Lille
Composés possédant une liaison azote-azote ou azote-oxygène
Introduction
Classe
|
|
|
|
|
|
Dérivé nitré |
Oxime |
Hydrazone |
Ion diazonium |
|
|
|
|
|
|
Oxyde d'amine |
Azoture |
Diazoalcane |
Nitrone |
Dérivés nitrés
Préparation
Les dérivés nitrés aliphatiques ou nitroalcanes les plus simples sont obtenus industriellement par nitration d'alcanes en phase vapeur.
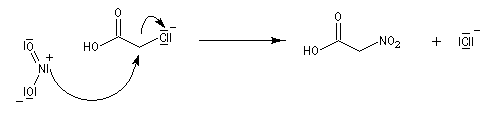
Au laboratoire, on peut accéder aux nitroalcanes par substitution à partir d'acides carboxyliques a-halogénés suivie d'une élimination.
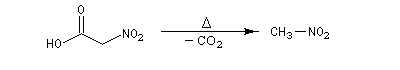
Une autre méthode consiste à réduire un nitroalcène par NaBH4
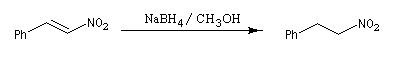 La préparation des dérivés nitrés aromatiques a été étudiée dans le chapitre sur les composés aromatiques.
La préparation des dérivés nitrés aromatiques a été étudiée dans le chapitre sur les composés aromatiques.
Préparation : [14]
Application à la synthèse du nitrostyrène : [18] Acidité, tautomérie Le carbanion est stabilisé par résonance. Le composé I est la forme nitro, le II est appelé aci-nitro. La constante d'équilibre est comprise entre 10-5 et 10-7. Réduction des dérivés nitrés La réduction des dérivés aromatiques conduit aux amines aromatiques. Réaction de Henry Les bases utilisées sont des alcoolates ou des amines tertiaires telle que DBU (1,8-diazabicyclo[5.4.0]undec-7-ène
) ou encore la tétraméthylguanidine (TMG).
Les composés carbonylés utilisés sont des aldéhydes ou des cétones. Avec ces dernières, la réaction est sensible aux facteurs stériques et conduit généralement à des mélanges de produits dont les proportions dépendent de la nature des réactifs, de la base utilisée, de la température et du temps de réaction. Le mécanisme de la réaction de Henry ressemble à celui de l'aldolisation entre composés carbonylés.
Point très important : le mécanisme de la réaction montre que les différentes étapes sont toutes réversibles. La réaction inverse s'appelle rétro-Henry. La réduction par hydrogénation en présence de Ni de Raney permet de passer des b-nitro-alcools aux
b-amino-alcools. L'oxydation des b-nitro-alcools par un réactif tel que le PCC (réactif de Corey-Suggs) permet la préparation d'a-nitrocétones.
Les carbanions préparés à partir de dérivés nitrés peuvent aussi s'additionnerde façon conjuguée dans une réaction de type Michaël.
Si l'on réalise ensuite une réaction de Nef sur le composé obtenu, on obtient un composé dicarbonylé 1,4. Pour davantage d'information sur les dérivés nitrés : [13] Il y a formation de deux centres chiraux. Il y a donc a priori, formation de quatre stéréoisomères constitués de deux couples d'énantiomères. A cet égard, la situation est assez comparable à celle de la condensation aldol.
Cependant, dans les conditions ordinaires, la réaction de Henry n'est pas stéréosélective et on obtient des mélanges de stéréo-isomères. Cela provient du caractère renversable de la réaction et de l'épimérisation facile de l'atome de carbone porteur du groupe nitro. Préparation Propriétés
Le groupe nitro est à la fois attracteur d'un point de vue inductif et mésomère.
Les composés qui possèdent un atome d'hydrogène sur le carbone en a du groupe nitro, ont un caractère acide.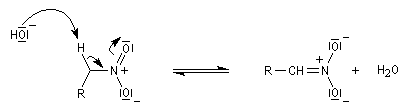
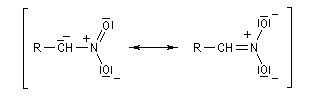
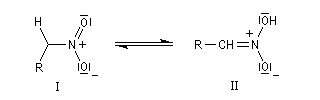
Les dérivés nitrés aliphatiques peuvent être réduits en amines par simple hydrogénation.![]()
Découverte par L. Henry en 1895. Elle est aussi nommée nitro-aldol en raison de sa parenté avec la condensation aldolique.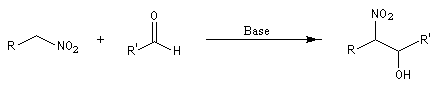
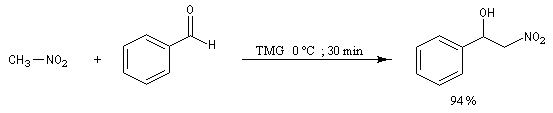
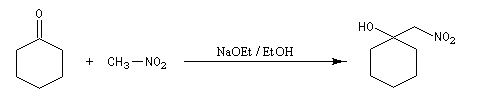
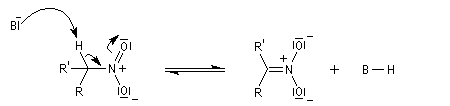
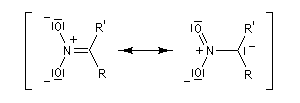
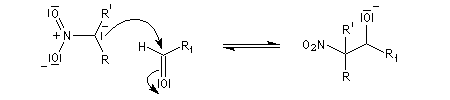
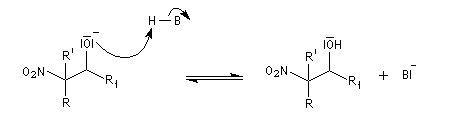
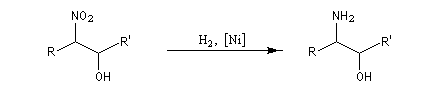
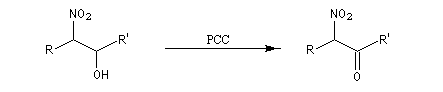

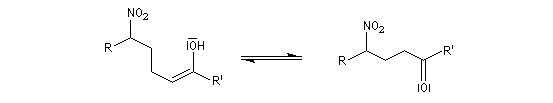
La première version énantiosélective ("asymétrique") remonte aux travaux du chimiste japonais, Shibasaki en 1992. On l'appelle la Réaction de Shibasaki-Henry. Le catalyseur est un complexe de terre rare utilisant un ligand de type binaphtyle atropique [50]. Cette réaction a été appliquée à la synthèse de la chaîne latérale du taxol.
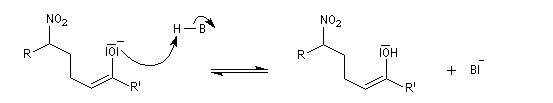
La déshydratation des b-nitro-alcools par un agent déshydratant tel que le dicyclohexylcarbodimide DCC conduit aux nitroalcènes. On obtient un mélange de diastéréo-isomères Z et E .
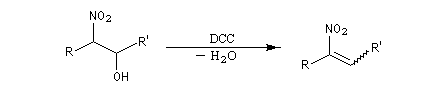
.
Les nitroalcènes sont des réactifs utiles dans plusieurs réactions :
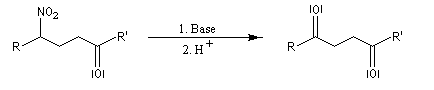
Réaction de Nef
Lorsque l'on traite le sel de sodium du nitroéthane par un acide fort comme H2SO4, on obtient de l'éthanal avec un rendement voisin de 70 %. Cette réaction découverte par le chimiste américain d'origine helvétique John Ulric Nef permet de préparer des composés carbonylés à partir de nitroalcanes.
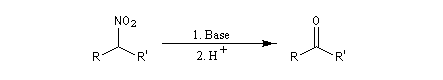
Le mécanisme de la réaction de Nef classique, fait intervenir les étapes suivantes.
En milieu basique, le dérivé nitré donne facilement un carbanion.
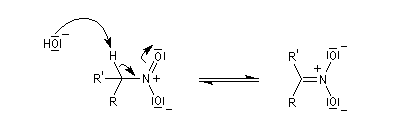
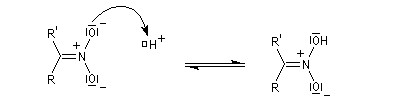
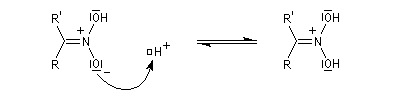
l'intermédiaire est ensuite hydrolysé.
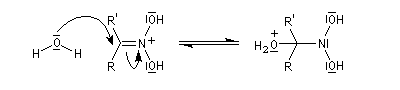
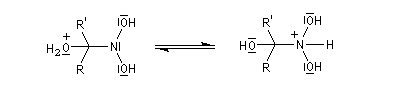
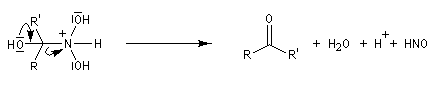
Oximes
Préparation des oximes
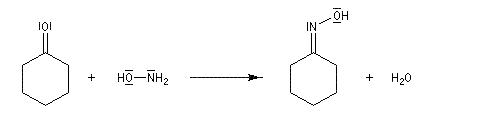
Les oximes peuvent être considérées comme le produit de condensation de l'hydroxylamine avec un composé carbonylé.
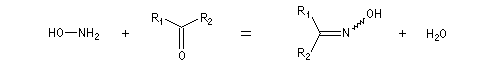
La présence de la double liaison carbone-azote entraîne l'existence de deux diastéréo-isomères.
Exemple de préparation : oxime de la benzophénone [19] Hydrolyse des oximes Réduction des oximes Transposition de Beckmann des oximes La réaction nécessite un acide de Lewis comme catalyseur. Parmi les catalyseurs employés, on peut citer : les acides protiques, PCl5, SOCl2, etc. Le mécanisme est donné ci-dessous avec H+
L'hydrolyse est catalysée par les acides. Elle conduit aux composés carbonylés "parents" aldéhyde ou cétone et à l'hydroxylamine.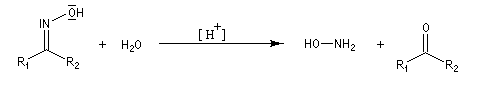
Les oximes peuvent être facilement réduites en amines par différents réducteurs. Parmi ceux-ci, on peut citer : LiAlH4, ou B2H6 dans le THF. Zn dans AcOH donne également de bons résultats.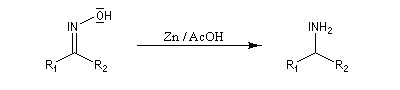
La transposition de Beckmann est une réaction d'isomérisation d'une oxime en amide. Le bilan de la transformation peut être résumé par l'équation suivante.
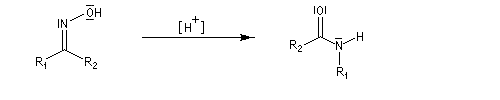
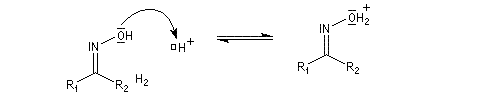
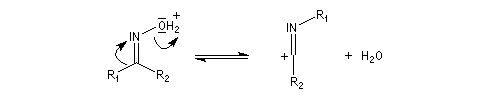
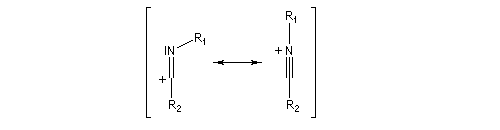
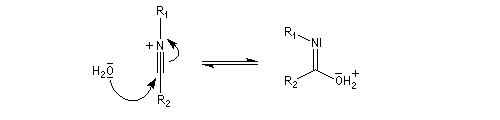
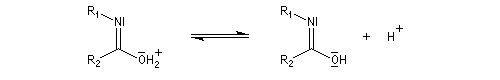
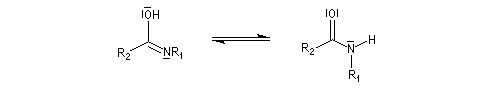
Lorsque l'oxime existe sous deux formes diastéréoisomères Z et E, le groupe qui migre de façon préférentielle est celui situé en anti du groupe OH de l'oxime.
Une illustration importante de la transposition de Beckmann est la préparation du caprolactame.
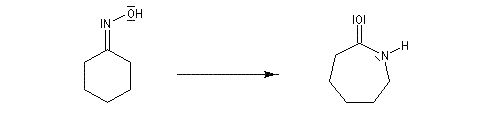
autre application : [28]
Dégradation de Wohl
Cette réaction, qui permet de diminuer la chaîne carbonée d'un ose, a été étudiée dans le chapitre consacré aux composés carbonylés.
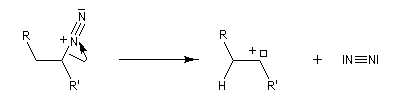
Préparation Les propriétés des hydrazones en tant que dérivés caractéristiques des composés carbonylés et des sucres ont été citées dans le chapitre correspondant. Notons que la réaction de Wolff-Kishner, qui permet la réduction d'un groupe carbonyle en méthylène vis l'hydrazone correspondante a été citée dans ce même paragraphe. Réaction de Bamford-Stevens Le mécanisme est le suivant : Formation d'un carbocation par élimination de diazote. Elimination à partir du carbocation et formation d'un composé éthylénique. Réaction de Shapiro Le mécanisme est le suivant : Formation d'un carbanion et départ de diazote. L'un des avantages de cette réaction par rapport à la réaction de Bamford-Stevens est que les intermédiaires sont des carbanions, qui, à la différence des carbocations et des carbènes ne sont pas susceptibles de subir une transposition [47]. Un exemple d'application à la synthèse du bornène est donné à la référence [39]. La réaction de Shapiro a été utilisée par K. C. Nicolaou dans sa synthèse du Taxol. Synthèse des indoles de Fischer Cette phénylhydrazone chauffée en présence d'ions H+ ou d'un acide de Lewis comme ZnCl2 est cyclisée pour conduire à un noyau indole. Le mécanisme fait intervenir les étapes suivantes :
L'hydrazine et ses dérivés réagissent avec les composés carbonylés pour donner des hydrazones substituées ou non.
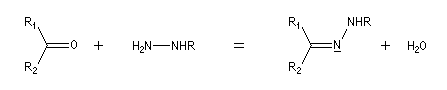
En présence de bases très fortes comme des alcoolates, les tosylhydrazones peuvent être converties en composés éthyléniques grâce à la réaction de Bamford-Stevens [46].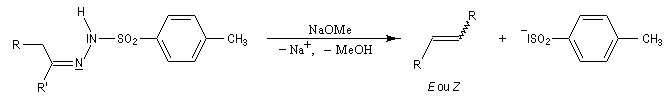
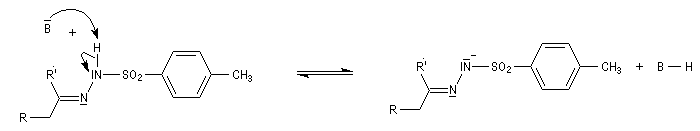
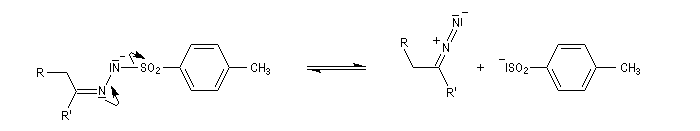
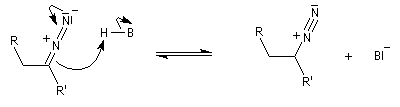
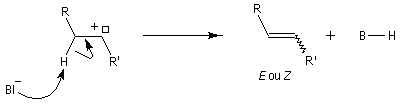
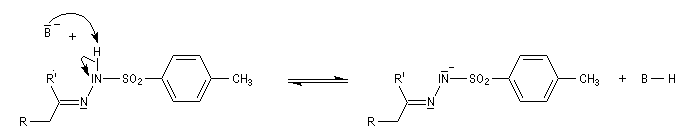
Il s'agit d'une variante de la réaction de Bamford-Stevens dans laquelle la base forte est un organolithien.
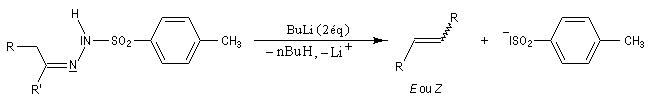
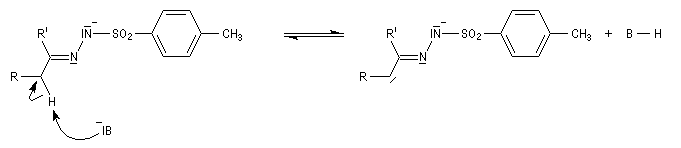
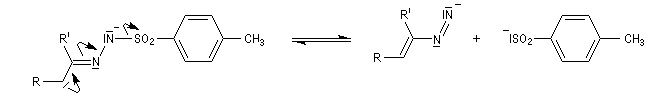
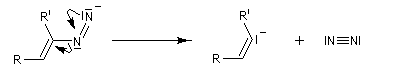
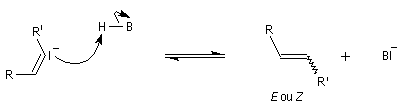
La découverte de la phénylhydrazine par Fischer en 1875 a largement influencé ses travaux ultérieurs concernant la chimie des sucres et celle de l'indole et de ses dérivés [20].
La réaction entre la phénylhydrazine et un composé carbonylé énolisable, donc possédant au moins un atome d'hydrogène en a du carbonyle, fournit une phénylhydrazone.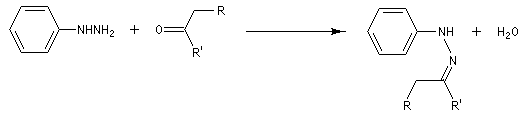
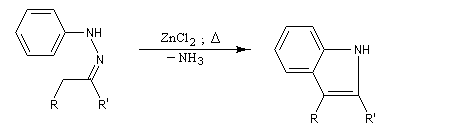
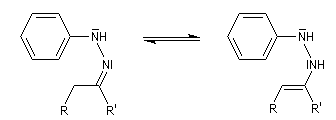
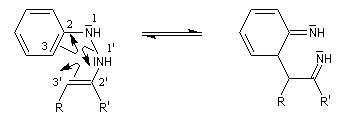
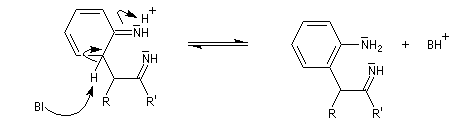
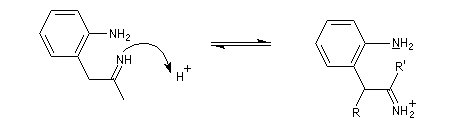
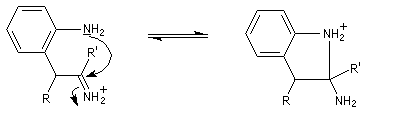
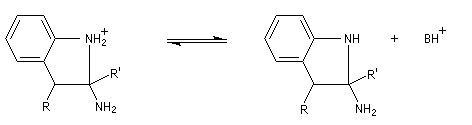
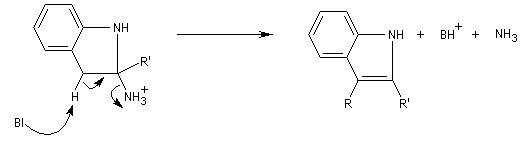
Il faut noter que la synthèse de Fischer n'est pas adaptée à la synthèse de l'indole lui même mais plutôt à ses dérivés substitués.
Article original : [48]. Emil Fischer a obtenu le prix Nobel de chimie en 1902 pour l'ensemble de ses travaux en chimie organique [20]
Applications : la méthode a été utilisée avec succès comme étape dans la synthèse de composés naturels comme la strychnine (R. B. Woodward, 1954) [62].
Les dérivés de la triptamine comme le médicament antimigraineux sumatriptan, sont synthétisés selon cette méthode.
De nombreux composés d'origine naturelle contiennent dans leur structure un noyau indole. Citons par exemple l'acide lysergique dérivé de l'ergot de seigle.
|
|
L’ergot de Seigle, Claviceps purpurea, est un champignon parasite de certaines céréales (seigle, riz etc) qui contient plusieurs alcaloïdes polycycliques dérivés de l'acide lysergique. Ces composés sont responsables d'une affection appelée ergotisme. La toxine est un puissant vasoconstricteur qui bloque la circulation dans les extrémités. Après une phase convulsive qui peut durer plusieurs semaines, la maladie conduit presque inéluctablement à la mort. Au Moyen Age, cette maladie redoutable était connue sous le nom de "mal des ardents" ou "feu de Saint-Antoine". Information sur les alcaloïdes de l'ergot [17] Synthèse par R. B. Woodward et son équipe [45] |
Préparation des ylures d'ammonium
La découverte des ylures d'ammonium (ou plus simplement : ylure d'azote) remonte aux travaux de G. Wittig. En faisant réagit le méthylithium sur l'ion tétraméthylammonium, on assiste à la métallation d'une liaison C-H du substrat et à la formation d'un ylure d'ammonium (en anglais : ammonium ylides.)
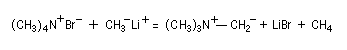
Comme tous les ylures, ce sont des dipôles 1,2 dans lequel l'atome de carbone et l'atome d'azote contigü portent des charges opposées. Ils sont beaucoup plus basiques et beaucoup plus réactifs que les ylures de phosphore et de soufre car, à la différence de ces derniers, l'atome d'azote ne dispose pas d'orbitales d vacantes susceptibles de stabiliser la charge négative.
Diazoalcanes
Les diazoalcanes sont des ylures d'alcanediazonium. Leur formule générale peut être représentée par les formes de résonance suivantes :
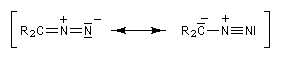
Les a-diazocétones peuvent être considérées comme des diazoalcanes stabilisés grâce à la présence du groupe carbonyle adjacent. On les obtient par réaction entre le diazométhane et un chlorure d'acyle.
Elles présentent l'intérêt synthétique de conduire aux cétènes via la transposition de Wolff.
Les diazoalcanes non stabilisés sont instables et se décomposent spontanément.
Diazométhane
Le diazométhane est le plus simple des diazoalcanes.
Le diazométhane est un gaz de couleur jaune à une température supérieure à - 23 °C (sous 1 bar.) C'est un composé extrêmement toxique, et instable. Sa manipulation (solution à 50 % dans l'éthoxyéthane) nécessite des précautions particulières qui sont rappelées à la référence [15]. Le diazométhane qui n'a pas été utilisé dans une synthèse doit être détruit (il suffit de le mettre en présence d'acide acétique dans l'éther.)
Sa structure est celle d'un ylure d'alcanediazonium.
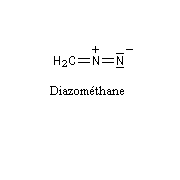
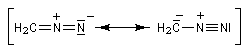
|
|
L'une des méthodes de préparation classique du diazométhane consiste à traiter la N-méthyl-N-nitroso-p-toluènesulfonamide (Diazald) en milieu basique à chaud dans le DGME (voir par exemple OS [15].)
|
Ions diazonium
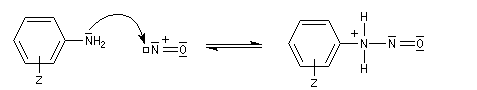
Préparation des ions diazonium
Les ions diazonium peuvent être préparés par réaction entre une amine primaire et un nitrite en milieu acide. Le réactif électrophile est le cation nitrosonium NO+, formé à partir d'un nitrite en milieu acide.
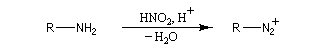
Amines non aromatiques
Avec une amine non aromatique, l'ion diazonium est instable et labile. Sa décomposition spontanée fournit un dégagement de diazote, molécule très stable et excellent nucléofuge.
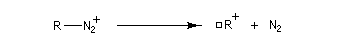
Le carbocation obtenu, très réactif, peut évoluer de nombreuses manières ce qui conduit à un mélange complexe de produits de substitution et d'élimination. Le tableau ci-dessous regroupe les différents composés issus de la désamination nitreuse de la butylamine.
|
butan-1-ol |
butan-2-ol |
1-chlorobutane |
2-chlorobutane |
|
25 % |
13 % |
5 % |
3 % |
|
but-1-ène |
but-2-ène (Z et E) |
|
26 |
10 |
(la somme des pourcentages n’est pas égale à 100 car il se forme des traces d’autres composés).
Application : réaction d'agrandissement de cycle de Demyanov
La réaction de désamination nitreuse peut être mise à profit pour réaliser des agrandissements de cycles grâce à des transpositions de carbocations (réaction de Demyanov).
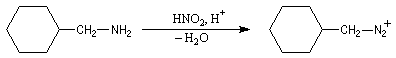
Lors de la désamination il y a migration de la branche du cycle en position anti par rapport à la liaison C-N qui se rompt.
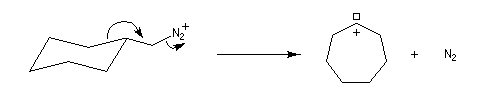
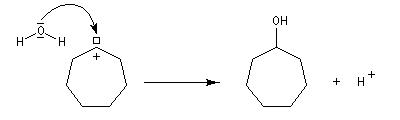
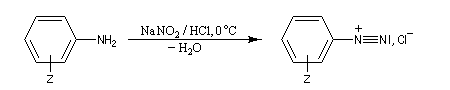
Le mécanisme est le suivant.
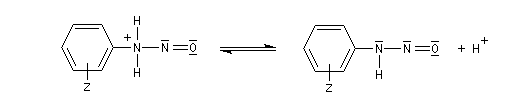
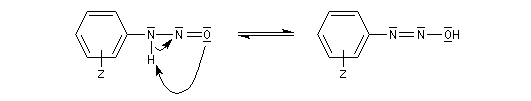
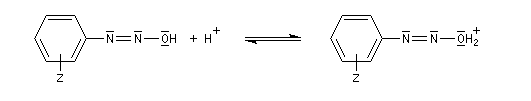
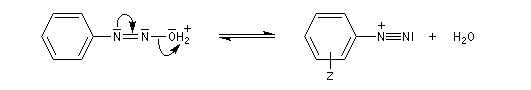
On peut rendre compte de la relative stabilité des ions diazonium en utilisant la méthode de la mésomérie.
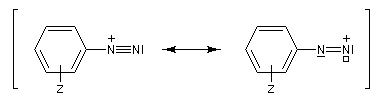
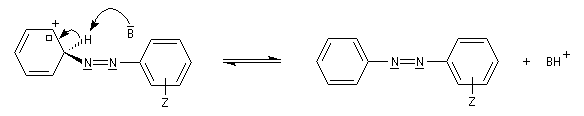
Couplage des ions diazonium aromatiques
Les ions diazonium réagissent comme des électrophiles assez faibles dans des réaction de substitution aromatique appelées copulations.
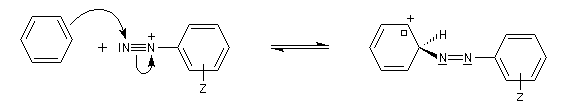
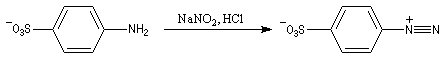
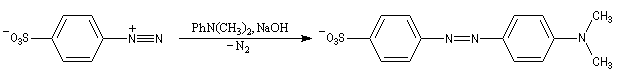
Utilisation de l'hélianthine comme indicateur coloré
L'hélianthine ou orange de méthyle se présente sous la forme d'un composé solide de couleur orange soluble dans l'eau (I).
|
|
|
|
|
I |
II |
III |
Le couplage peut être intramoléculaire. Le benzotriazole peut être préparé par la réaction suivante [6] :
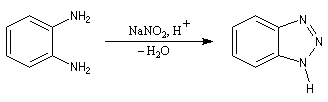
Réduction des ions diazonium
On utilise un réducteur comme EtOH ou H3PO2.
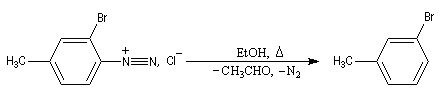
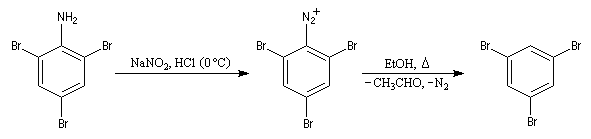
La réaction constitue une méthode de désamination des cycles aromatiques. Elle peut être très utile afin d'éliminer un groupe amino dont on a utilisé temporairement le caractère activant et orienteur. L'exemple de la synthèse du 1,3,5-tribromobenzène [6] témoigne de cette façon de procéder :
Substitutions nucléophiles Il s’agit d’une méthode d’iodation des cycles aromatiques. Rappelons que l’iodation d'un cycle aromatique par substitution électrophile n'est pas facilement réalisable(il faut utiliser un mélange de diiode et d'acide nitrique afin de former une petite quantité d'iode cationique.)
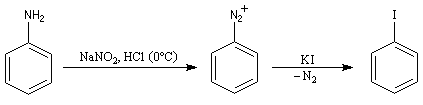
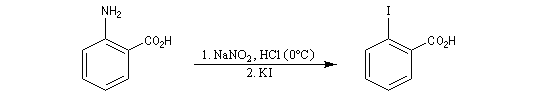
Il constitue un point de départ dans la synthèse du réactif de Dess-Martin, un composé permettant l'oxydation d'un alcool en composé carbonylé.
L'iodation d'un cycle aromatique intervient également dans la synthèse de la thyroxine.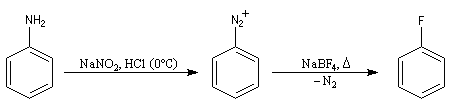
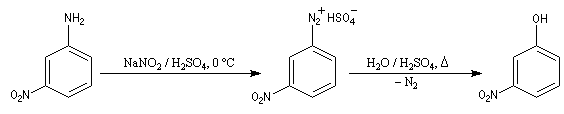
Le cation aryldiazonium intermédiaire se décompose pour donner un cation aryle et du diazote, petite molécule très stable, qui constitue l'un des meilleurs nucléofuges connus. C'est l'étape cinétiquement déterminante de la réaction.
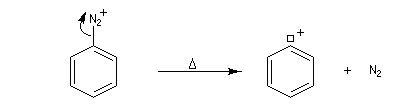
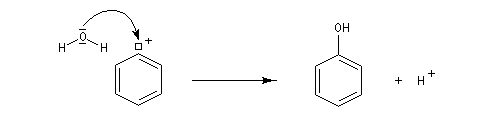
Le cation aryle extrêmement réactif réagit avec tout nucléophile présent dans le milieu réactionnel.
Couplage radicalaire, réaction de Sandmeyer
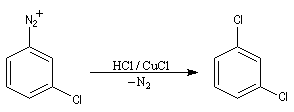
La réaction est comparable aux précédentes. L'halogénure est remplacé par du cyanure de cuivre (I) CuCN. on prépare ainsi le benzonitrile.
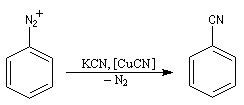
Elimination-décarboxylation
La diazotation de l'acide anthranilique suivie d'une élimination de N2 et de CO2 constitue une méthode douce de
préparation du benzyne.
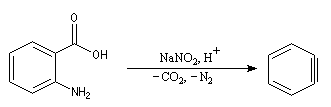
Préparation des oxydes d'amines
Les amines sont des composés assez sensibles à l'oxydation. Les produits de réaction dépendent de la classe de l'amine et de la nature de l'oxydant utilisé. La réaction la plus importante concerne les amines tertiaires. Les oxydants utilisés sont le m-CPBA, le peroxyde d'hydrogène ou encore l'acide peroxymonosulfurique (acide de Caro).
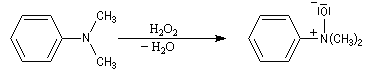
Réaction de Polonovski-Potier
La réaction de Polonovski (Max et Michel Polonovski 1927) met en jeu un oxyde d'amine et un anhydride d'acide comme l'anhydride acétique. Le produit de la réaction est un amide N,N-disubstitué et un aldéhyde (le méthanal si l'oxyde d'amine de départ comporte un substituant méthyle).
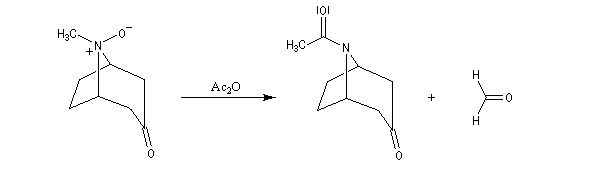
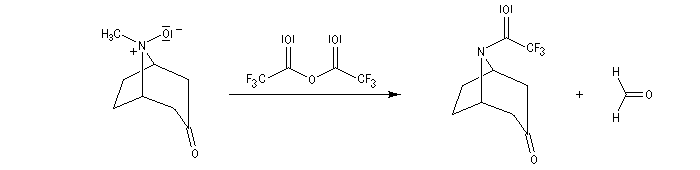
L'oxyde d'amine réagit suivant un mécanisme d'addition-élimination sur le dérivé d'anhydride d'acide.
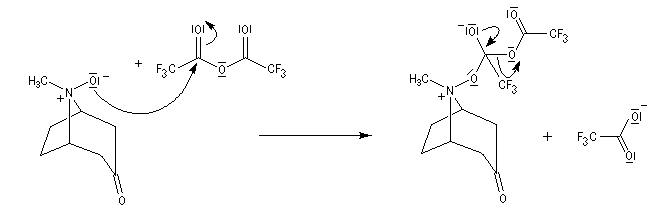
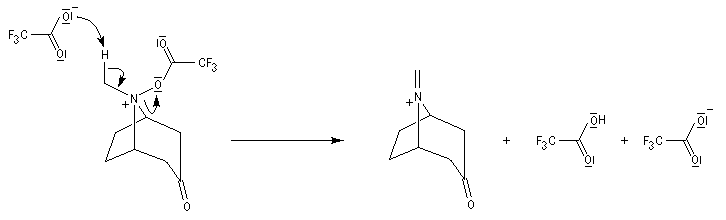
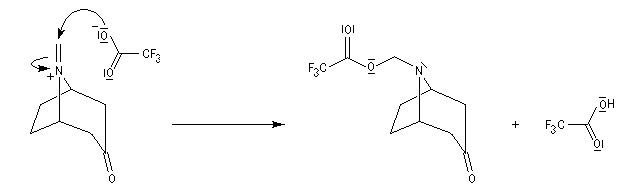
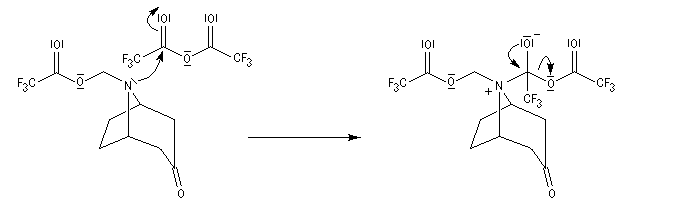
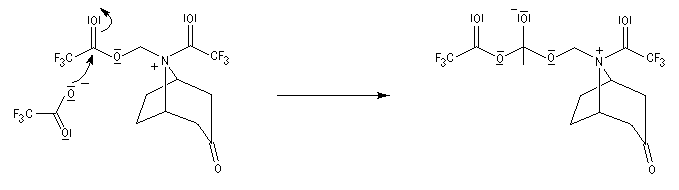
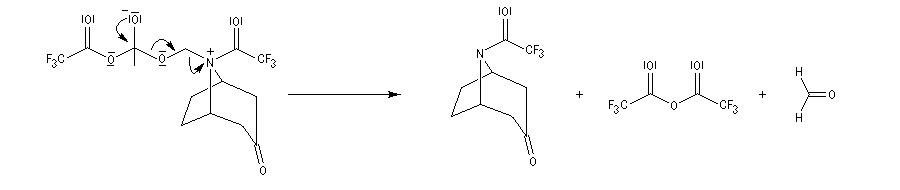
La réaction a été modifiée par le chimiste français Pierre Potier (CNRS, Institut de Chimie des Substances Naturelles de Gif) qui a remplacé l'anhydride acétique par l'anhydride trifluoroacétique. Il l'a ensuite mise à profit pour modifier le squelette de molécules appartenant à la famille des alcaloïdes [37].
Application de la réaction de Polonovski-Potier à l'hémisynthèse de la vinorelbine
"La chimie est à la biologie ce que le solfège est à la musique" Pierre Potier.
|
|
La vinorelbine (commercialisée sous le nom de Navelbine®) est un médicament utilisé en chimiothérapie anticancéreuse. Sa synthèse s'effectue à partir de deux molécules extraites de la pervenche de Madagascar (Canthareus roseus) : la catharanthine et la vindoline. Le couplage chimique de ces sous-unités conduit dans un premier temps à l'anhydrovimblastine qui est ensuite transformée en vinorelbine par une suite de réactions dont l'étape clé est la réaction de Polonovski-Potier. Il faut extraire environ 20 tonnes de feuilles séchées pour produire 1 kilogramme du médicament [42]. |
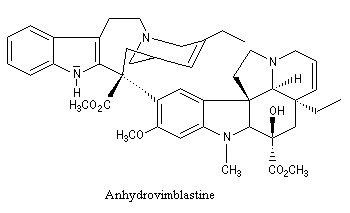
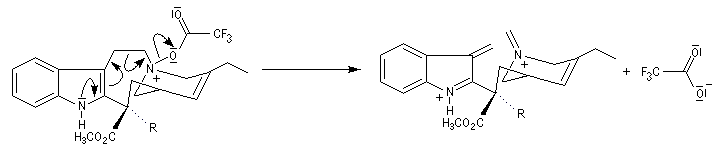
Les différentes étapes de la transformation sont résumées ci-dessous. Le substrat de départ comporte un cycle à 9 chainons tandis que dans la molécule cible, le cycle correspondant n'en comporte que 8.
Réaction entre l'oxyde d'amine et l'anhydride d'acide.
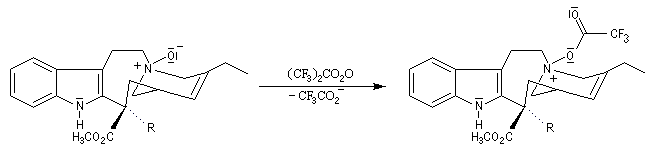
Clivage de la liaison carbone-carbone avec formation d'un ion iminium. La réaction est facilitée par le départ de F3CO2-. Notons que l'atome d'azote quinolique participe au mécanisme.
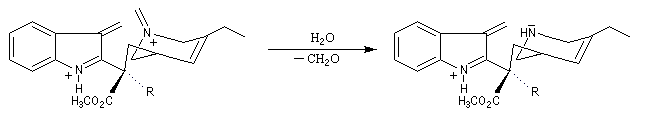
L'hydrolyse de l'ion iminium conduit à l'amine et au méthanal.
L'addition nucléophile de l'azote sur la double liaison conjuguée permet la cyclisation.
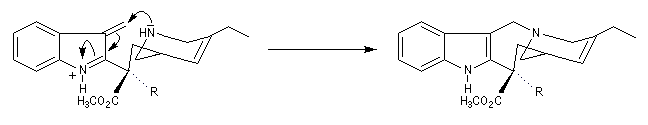
Comme on le voit, la transformation permet de passer d'un hétrocycle de 9 chainons à un hétérocycle à 8 chainons.
Elimination de Cope des oxydes d'amines
L'une des réactions importante des oxydes d'amines est l'élimination de Cope qui conduit aux composés éthyléniques. Il s'agit d'une b-élimination.
L'atome d'oxygène de l'oxyde joue le rôle de base tandis que l'atome d'azote positif est le nucléofuge. La réaction possède l'avantage d'être stéréospécifique de stéréochimie syn. L'exemple suivant concerne la préparation
du méthylènecyclohexane [24].
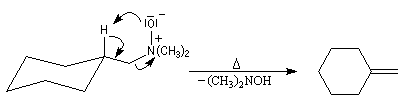
La cinétique de la réaction dépend beaucoup de la nature du solvant. Des accélérations souvent très importantes sont observées lorsqu'on passe d'un solvant protique à un solvant aprotique.
Article original : [44]
Préparation
On peut préparer les azotures d'alkyle par une réaction de substitution nucléophile sur un dérivé halogéné comme substrat. Le nucléophile est l'ion azoture (en anglais : azide) dont une source commerciale est l'azoture de sodium. Ce réactif est à la fois explosif et toxique
.
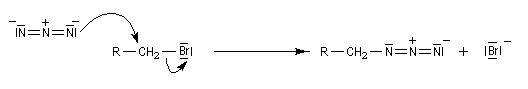
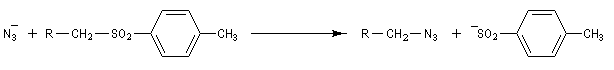
Réduction
Les azotures d'alkyles sont facilement réduits en amines par hydrogénation catalytique ou en utilisant LiAlH4. Puisque les dérivés halogénés et les dérivés sulfonylés d'alcanes sont aisèment obtenus à partir des alcools, les azotures d'alkyles permettent le passage d'un alcool à une amine.
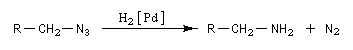
Exemple expérimental : [26]
Réaction de Staudinger (aza-Wittig)
Réaction mise au point par H. Staudinger [49]
La triphénylphosphine réagit sur un azoture pour donner un iminophosphorane.
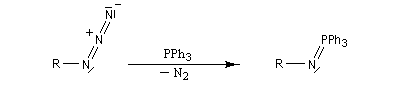
Le mécanisme est le suivant :
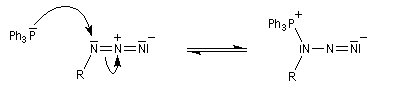
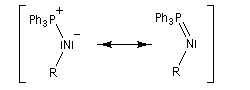
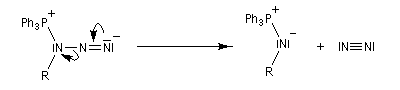
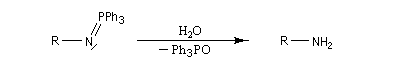
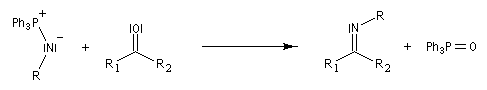
Transposition de Curtius La réaction peut s'arrêter au stade de l'acylazide. Exemple : [25].
L'ion azoture réagit avec les chlorures d'acycles pour donner des acylazides.
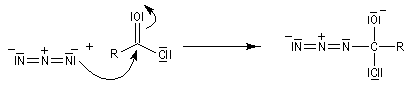
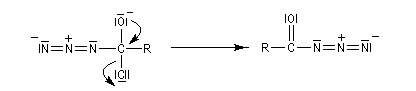
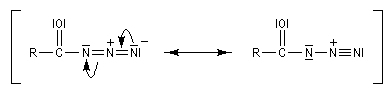
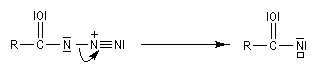
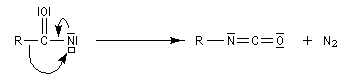
Les isocyanates sont des composés très réactifs qui peuvent conduire à de nombreux composés sous l'action d'une grande variété de nucléophiles. Par réaction avec l'eau, on obtient un acide carbamique, qui après décarboxylation fournit une amine.
En présence de tBuOH, on obtient des amines protégées par le groupe Boc (t-butoxycarbonyle).
Voir également :Préparation des nitrones
Les nitrones sont des N-oxydes d'imines. On peut les obtenir par plusieurs méthodes :
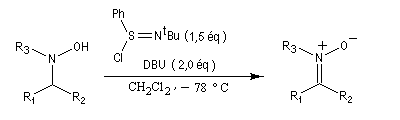
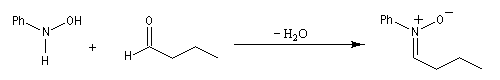
Les nitrones sont des composés dipolaires 1,3. Formellement ces composés ressemblent à un anion allylique.
Cycloaddition [3 + 2]
L'une des réactions les plus importantes des nitrones est leur cycloaddition avec les alcènes ou les alcynes [60].
La réaction entre une nitrone (dipôle) et le composé éthylénique (dipolarophile) peut conduire a priori à plusieurs composés. La régiochimie de l'addition peut être bien rationalisée en prenant en compte l'interaction entre les orbitales frontières des réactifs.
[38] Préparation de nitrones et cycloaddition-1,3-dipolaire.
Bibliographie [1] Manuel d'expériences de chimie - UNESCO Société chimique de France - Université de Montpellier. [13] Nitronates by Scott E. Denmark and Jeromy J. Cottell
[2] P. Rendle, M. V. Vokins, P. Davis, Experimental Chemistry (Edward Arnold).
[3] L. F. Fieser, K. L. Williamson - Organic Experiments (D. C. Heath and Company).
[4] R. Adams, J. R. Johnson, C. F. Wilcox - Laboratory Experiments in Organic Chemistry (The Macmillan Company, Collier-Macmillan Limited).
[5] G. K. Helmkamp, H. W. Johnson Jr, Selected Experiments in Organic Chemistry (W. H. Freeman and Co).
[6] Vogel's Textbook of Practical Organic Chemistry (Longman).
[7] J. R. Mohrig, D. C Neckers, Laboratory Experiments in Organic Chemistry (D. Van Nostrand Company).
[8] R. Q. Brewster, C. A. Van der Werf, W. E. Mc Ewen, Unitized Experiments in Organic Chemistry (D. Van Nostrand Company).
[9] F. G. Mann, B. C. Saunders, Practical Organic Chemistry (Longman).
[10] M. T. Yip, D. R. Dalton, Organic Chemistry in the Laboratory (D. Van Nostrand Company).
[11] Journal of Chemical Education vol 55, 1977.
[12] S. Hünig, E. Lücke, W. Brenninger, Organic Syntheses, V, p 533.
[14] Préparation of Nitromethane by F. C. Whitmore and Marion G. Whitmore
[15] Diazomethan by Th. J. de Boer and H. J. Backer
[16] Montage de distillation pour la préparaton du diazométhane
[17] Le mal des ardents : la chimie de l'ergot de seigle
[18] Nitrostyrène by David E. Worrall
[19] Benzophenone oxime Arthur Lachman
[20] Emil Fischer, prix Nobel de chimie 1902
[21] R. B. Woodward - The Nobel Prize in chemistry 1965
[22] p-fluorobenzoic acid by G. Schiemann and W. Winkelmüller
[23] 1-chloro-2,6-dinitrobenzene Organic Syntheses, Vol. 32, p. 23 (1952); Coll. Vol. 4, p.160 (1963)
[24] Preparation of methylenecyclohexane by Arthur C. Cope and Engelbert Ciganek, Massachusetts Institute of Technology, Cambridge 39, Massachusetts
[25] m-nitrobenzazid Organic Syntheses, Vol. 33, p. 53 (1953); Coll. Vol. 4, p.715 (1963).
[26] 2-phenyl-2-adamentanamine hydrochloride Organic Syntheses, Vol. 60, p. 104 (1981) ; Coll. Vol. 7, p.433 (1990).
[27] Highlights of Schmidt reaction in the last ten years by Jack Liu
[28] The synthesis of laurolactame from cyclodecanone via a Beckmann rearrangment Journal of Chemical Education
[29] 1-Morpholino-1-cyclohexene by Hünig, E. Lücke, and W. Brenninger
[30] Hofmann rearrangement under mildy acidic condition by Merrick R. Almond, Julie B. Stimmel, E. Alan Thompson, and G. Marc Loud
[31] Curtius rearrangment Organic Chemistry Portal
[32] Henry reaction Organic Chemistry Portal
[33] Assymetric Henry and aza Henry reaction by D. J. Osborn
[34] Indole alkaloids in human medicine by Csaba
Szhntay Central Research Institute of Chemistry, Budapest
[35] Nitrone-olefin [3+2] cycloadditions
[36] A convenient method for synthesis of nitrone by Teruaki Mukaiyama
[37] Pierre Potier, médaille d'or du CNRS
[38] Nitrones for 1,3-dipolarcycloadditions by Norman A. LeBel and Dorothy Hwang.
[39] 2-bornène by R. H. Shapiro and J. H. Duncan.
[60] 1,3-dipolar Cycloaddition Reaction of Nitrones with Alkenes.
[61] Asymetric variants of the Henry reaction by J. Wilmot.
[62] Alcaloïdes Présentation des différents alcaloïdes
[63] Burke Laboratories
A. Streitwieser Jr, C. H. Heathcock - Introduction to Organic Chemistry, Macmillan Publishing Co.
J. March - Advanced organic chemistry, Wiley Interscience
F. A. Carey, R. S. Sunberg - Advanced Organic Chemistry, Plenum Press 1990.
J. C. Chottard, J. C. Depezay, J. P Leroux - Chimie fondamentale, Hermann 1982.
P. Laszlo - Logique de la synthèse organique. Cours de l'Ecole Polytechnique, Ellipses, 1993.
P. Atkins - General Chemistry, Scientific American Books W. H. Freeman and Co.
J. Koolman, K. H Röhm - Atlas de biochimie, Médecine & Sciences, Flammarion.
P. Caubère - La catalyse par transfert de phase et son utilisation en chimie organique, Masson 1982.
Organic Synthesis Highlights V, Edited by Hans-Günther Schmalz and Thomas Wirth, J. Wiley 2003.
Vous pouvez, si vous le souhaitez, utiliser le contenu de cette page dans un but pédagogique et non commercial.
Texte, dessins, photographies : Gérard Dupuis - Lycée Faidherbe de LILLE
mars 2015